БРОШЮРА ПРАКТИЧЕСКОГО ВРАЧА АКУШЕРА-ГИНЕКОЛОГА
УРОГЕНИТАЛЬНЫЙ ХЛАМИДИОЗ.
Профессор А.Л. Тихомиров, С.И. СарсанияПРОБЛЕМА.
Урогенитальный хламидиоз (УГХ) - является наиболее распространенной инфекцией, занимающей большой удельный вес среди всех ИППП.
Изучая проблему УГХ, мы столкнулись с тем, что пока остается достаточно белых пятен как в этиологии и патогенезе, так и в лечении и ведении таких больных. Безусловно, представленные в эпидемиологических обзорах цифры не отражают реальной картины заболеваемости. Это связано не только с преобладанием асимптомного течения заболевания, но и с отсутствием до настоящего времени совершенных методов диагностики и высоким процентом самолечения. Противоречивые рекомендации специалистов различного профиля, участие в лечебно-диагностическом процессе коммерческих структур способствуют формированию не всегда верных представлений о хламидийной инфекции не только у пациентов, но и у врачей. Это приводит не только к формированию так называемых «хламидиофобий», увеличению объемов медикаментозного лечения, персистенции и рецидивам инфекции, но и способствует, при недооценке проблемы, развитию грозных и опасных осложнений.
ЭПИДЕМИОЛОГИЯ В мире ежегодно регистрируется около 92 млн. больных урогенитальным хламидиозом. При этом в США - регистрируется 5 млн. новых случаев, в Западной Европе – 10 млн, в России – свыше 1,5 млн.
Удельный вес хламидийной инфекции среди ИППП по некоторым данным составляет 30–50% (Светачев М. М., Юрасов И. В., 2002). Так, урогенитальный хламидиоз встречается в 2-4 раза чаще, чем гонорея, в 7,5 раз чаще, чем сифилис. По данным CDC, частота регистрации УГХ в США, в 2005 г., составила 332,5 на 100.000 населения.
Заболеваемость хламидийной инфекцией в субъектах Российской Федерации
(Ресурсы и деятельность кожно-венерологических учреждений. Заболеваемость за 2003-2004 годы. Статистические материалы. 2005г).
Субъекты федерации
Заболеваемость хламидийной инфекцией
Абсолютные числа
На 100 000 населения
2003 2004
2003 2004 Российская Федерация 143898 145487 100.3 101.7 Центральный
федеральный округ32737 33729 86.5 89.4 Белгородская область 1394 2202 92.2 145.5 Брянская область 609 575 44.5 42.2 Владимирская область 1273 1215 84.2 80.8 Воронежская область 1520 1389 64.3 59.0 Ивановская область 559 685 49.2 60.6 Калужская область 205 214 19.8 20.8 Костромская область 695 838 95.2 115.5 Курская область 987 1141 80.7 94.0 Липецкая область 1958 2290 162.4 190.7 Московская область 8135 8321 122.9 125.7 Орловская область 984 648 115.2 76.2 Рязанская область 1508 1420 124.0 117.5 Смоленская область 873 1230 84.0 119.1 Тамбовская область 433 497 37.1 42.9 Тверская область 1107 1093 76.1 75.7 Тульская область 508 895 30.7 54.4 Ярославская область 1401 1310 103.2 97.0 гор. Москва 8588 7766 82.7 74.7 Северо-Западный
федеральный округ20627 21503 148.5 155.5 Республика Карелия 907 1152 127.4 162.6 Республика Коми 1510 1412 149.4 140.4 Архангельская область 2259 1521 170.5 115.4 Ненецкий автономный округ - - - - Вологодская область 1987 2317 157.5 184.5 Калининградская область 522 523 54.8 55.1 Ленинградская область 1470 2107 88.4 126.9 Мурманская область 2560 2852 289.3 324.1 Новгородская область 586 544 85.3 79.7 Псковская область 351 297 46.6 39.7 гор. Санкт - Петербург 8475 8778 182.6 189.8 Южный
федеральный округ14554 15213 66.9 70.0 Республика Адыгея 718 796 161.0 178.8 Республика Дагестан 895 895 34.5 34.4 Республика Ингушетия 4 31 0.8 6.5 Кабардино-Балкарская Респ. 619 539 68.8 60.0 Республика Калмыкия 234 155 80.3 53.3 Карачаево-Черкесская Респ. 142 165 32.4 37.8 Р. Северная Осетия - Алания 851 811 120.1 114.7 Краснодарский край 3479 4288 68.0 84.0 Ставропольский край 1705 1613 62.5 59.2 Астраханская область 2529 2239 252.1 223.6 Волгоградская область 1985 2236 74.0 83.6 Ростовская область
1393 1445 31.8 33.1 Субъекты федерации
Заболеваемость хламидийной инфекцией
Абсолютные числа
На 100 000 населения
2003 2004
2003 2004 Приволжский
федеральный округ30073 29357 97.0 95.0 Республика Башкортостан 4805 4550 117.3 111.2 Республика Марий Эл 153 230 21.1 31.9 Республика Мордовия 547 582 62.1 66.4 Республика Татарстан 2885 2911 76.4 77.2 Удмуртская Республика 2986 2407 190.9 154.3 Чувашская Республика 740 540 56.6 41.4 Кировская область 2336 2673 156.9 180.7 Нижегородская область 1698 1815 48.5 52.2 Оренбургская область 2541 2994 117.1 138.4 Пензенская область 2178 1668 151.0 116.2 Пермская область 1423 1609 50.8 57.6 Коми-Пермяцкий авт.округ 36 55 26.7 40.9 Самарская область 5011 4603 155.3 143.1 Саратовская область 1940 1906 73.1 72.1 Ульяновская область 830 869 60.5 63.7 Уральский
федеральный округ
20503 19915 166.2 161.7 Курганская область 583 537 57.7 53.5 Свердловская область 6638 6268 148.7 140.9 Тюменская область 7393 6638 225.4 201.8 Ханты-Мансийский авт.округ 3655 3350 252.6 230.0 Ямало-Ненецкий авт. округ 494 493 96.5 95.7 Челябинская область 5889 6472 164.2 181.1 Сибирский
федеральный округ
18478 17718 92.5 89.0 Республика Алтай 3 45 1.5 22.1 Республика Бурятия 405 528 41.5 54.2 Республика Тыва 788 739 257.5 241.2 Республика Хакасия 558 467 102.6 86.1 Алтайский край 1733 1494 66.8 57.8 Красноярский край 1750 1839 59.3 62.5 Таймырский авт. округ 8 8 20.2 20.3 Эвенкийский авт. округ - - - - Иркутская область 4902 4652 190.8 181.7 Усть-Ордынский Бур.авт.ок. 127 105 94.2 78.0 Кемеровская область 2126 1790 73.7 62.3 Новосибирская область 2323 2369 86.7 88.6 Омская область 3035 2908 146.8 141.3 Томская область 752 697 72.1 67.0 Читинская область 103 190 9.0 16.6 Агинский Бурятский авт. окр. - 17 - 23.4 Дальневосточный
федеральный округ
6926 8052 104.0 121.4 Республика Саха (Якутия) 2154 2037 227.0 214.7 Приморский край 1734 1466 84.2 71.5 Хабаровский край 992 1946 69.3 136.4 Амурская область 618 691 68.8 77.3 Камчатская область 396 608 111.1 171.4 Корякский авт. округ - - - - Магаданская область 115 175 63.9 98.1 Сахалинская область 687 650 126.9 120.8 Еврейская авт. область 227 428 119.4 225.6 Чукотский автономный округ 3 51 5.7 99.2 С декабря 1993 г. УГХ включен в группу инфекционных заболеваний, подлежащих обязательному статистическому учету, что подчеркивает медико-социальную значимость данной патологии. Однако представленные цифры, повидимому, не отражают реальной картины заболеваемости. Существует мнение, что в действительности истинная заболеваемость значительно превышает данные официальной статистики (Халдин А. А., 2004), имея признаки эпидемии (Молочков В. А., Зур Н. Н., 2003). По некоторым оценкам, в Российской Федерации в год заболевает УГХ от 1,5 до 2 млн. человек (Калинина С. Н. и соавт., 2003), при этом в большинстве наблюдений этиологический диагноз болезни не устанавливается (Лебедев В. А., Давыдов А. И., 2002). По данным ВОЗ, в 35-50% – хламидийная инфекция протекает под маской других заболеваний.
По статистике Всероссийского центра по хламидиозам, хламидийная инфекция диагностируется как:
- негонококковый уретрит – в 20-70%,
- постгонококковый уретрит – в 40-80%,
- цистоуретрит – 30-40%,
- цервицит – 30-50%,
- б-нь Рейтера в 30-50%,
- сальпингит – 20-30%,
- конъюнктивит – 5-14%.
Причиной ВЗОМТ в 60-70% является сочетание хламидиоза и гонореи.
У 60% инфицированных женщин увеличивается риск заражения ВИЧ, при этом штаммы ВИЧ-инфекции, выделенные от таких больных, более вирулентны.
Хламидии, при эктопии шейки матки, обнаруживают в 47% случаев. Имеются предположения, что гиперпластические процессы в шейке матки, вызываемые хламидиями, могут способствовать развитию опухоли. Так, у женщин с неоплазией шейки матки хламидии обнаруживали в 8%, при цервикальном раке – в 18% случаев, а в группе контроля (здоровые женщины) – лишь в 1% случаев.
При бесплодии хламидии обнаруживают в 50- 57% случаев. При этом наблюдают не только функциональные нарушения репродуктивной деятельности, но и вовлечение в процесс систем регуляции гомеостаза, иммунокомпетентных клеткок и др.
Частота хламидийного инфицирования при трубном бесплодии составляет 41-54% (Серов В.Н. и соавт., 1996). После первого случая хламидиоза риск трубного бесплодия возрастает на 10%, а после третьего — на 50% (Филип Хэй. Лондон, 1999).
В бесплодных браках 50-55% мужчин стерильны, из них у 64% стерильность обусловлена УГХ. Хламидии могут вызвать бесплодие в результате прямого воздействия на сперматозоиды вследствие плотного прилипания хламидий к мужским гаметам, что препятствует оплодотворению яйцеклетки. Изучение состава незрелых половых клеток эякулята у больных УГХ выявило нарушение мейотических процессов в клетках-предшественниках сперматозоидов (Кубанова А.А. и соавт., 2000).
Некоторыми авторами отмечено, что развитие вторичного бесплодия у женщин при восходящей хламидийной УГИ наблюдается в 6 раз чаще, чем при гонорее.
При эктопической беременности C. trachomatis обнаруживают в 9-30% случаев. За последние годы отмечено увеличение числа хламидиоза беременных (10- 40%) и новорожденных. Инфицированные женщины в 40-60% случаев передают инфекцию новорожденным.
В возрасте 15-19 лет УГХ диагностируется у 46%, в 20-24 лет – у 30%.
Уровень заболеваемости достаточно высок не только среди взрослого населения и подростков, ведущих активную половую жизнь, но и среди детей младшего возраста, не живущих половой жизнью. Так, при обследовании мальчиков до 12 лет, обратившихся в детский кабинет УГИ, у 67,4% была выявлена C. trachomatis. При этом клиническая картина УГХ соответствовала уретриту, а у 7,9% детей по УЗИ имелись следы перенесенного простатита (Малова И. О., Сокольникова Н. В., 2001).
Очень важно, что у 75% женщин отмечено асимптомное течение заболевания, а у подростков в 30-40% случаев имеет место скрытая хламидийная инфекция, которая протекает в течение 2-5 лет. Поэтому в некоторых странах приняты рекомендации по ежегодному скринингу на хламидиоз сексуально-активных подростков и женщин в возрасте 20-24 лет с целью предотвратить возможные последствия хламидийной инфекции.
Проведенные нами собственные исследования позволяют нам рекомендовать для сохранения репродуктивного здоровья поколения, проведение скрининга на хламидиоз в более ранних возрастных группах сексуально-активных подростков. Так, как при
скрининговом обследование 150 подростков в возрасте от 13-18 лет обнаружено:
наибольшая частота выявления C. trachomatis наблюдалась в возрасте 17 лет + 0,22;
наличие Chlamydia trachomatis у 34%, при этом как моноинфекция Chlamydia trachomatis была отмечена в 14%. Сочетание с уреаплазмами, микоплазмами – наблюдали в 54%, с бактериальным вагинозом в 30%, с трихомонадами в 2% случаев.
Начало половой жизни регистрировалось в 14+1,08 лет, а количество половых партнеров преимущественно от 3 до 5.
На момент обследования фиксирование C.trachomatis второй раз в жизни - у 14,6%.
При обследовании 300 пациенток различных возрастных групп с воспалительными заболеваниями половых органов в условиях гинекологического отделения (стационар и амбулаторный прием), C. trachomatis были обнаружены в 19,3%.
Учитывая все выше перечисленное, для сохранения репродуктивного здоровья поколения, возможно рекомендовать проведение скрининга на хламидиоз в более ранних возрастных группах сексуально-активных подростков.
ЭТИОЛОГИЯ
На 4-м Европейском конгрессе «Хламидия -2000» (Хельсинки, 2000) была принята новая международная классификация хламидий.
Определение генома уже известных видов хламидий способствовало пересмотру их номенклатуры.
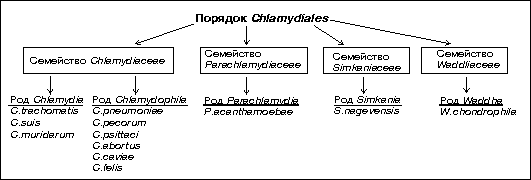
Классификация хламидий и хламидия-подобных микроорганизмов основана на наличии >95% гомологии в нуклеотидной последовательности генов 16S и 23S рРНК для всех представителей рода и >90% - семейства. Ранее неклассифицированные микроорганизмы, имеющие сходный с хламидиями цикл развития, были выделены в четыре дополнительных семейства в составе порядка Chlamydiales – Chlamydiaceae, Parachlamydiaceae, Simkaniaceae, Waddliaceae.
Наиболее радикальные изменения произошли в систематике семейства Chlamydiaceae, в котором в настоящее время выделено два рода – Chlamydia и Chlamydophila. Они отличаются между собой и по ряду фенотипических признаков. Представители рода Chlamydia, к которому относится единственный патогенный для человека вид Chlamydia trachomatis, содержат сходные по ультраструктуре экстрахромосомные элементы и способны накапливать гликоген во включениях. Элементарные тельца (ЭТ) представителей этого рода, внедрившись в клетку организма-хозяина, стремятся слиться в одно общее большое включение, биологический смысл которого состоит в обмене генетической информацией, что обусловливает большую генетическую вариабельность возбудителя.
Фундаментальные изменения, внесенные в классификацию представителей порядка Chlamydiales должны быть учтены при диагностике хламидийной инфекции. Это связано с тем, что все виды, входящие в семейство Chlamydiaceae, обладают сходной структурой липополисахаридного антигена и распознаются моноклональными антителами, специфичными к трисахаридному фрагменту alphaKdo-(2-8)-alphaKdo-(2-4)-alphaKdo ЛПС. В связи с этим многие из них в ПИФ и серологических методах идентифицируются как Chlamydia trachomatis.
Chlamydia trachomatis имеют 2 биовара, 15 сероваров, вызывает трахому, урогенитальные заболевания, некоторые формы артрита, конъюнктивит и пневмонию новорожденных.
Возбудителем УГХ является C.trachomatis (серовары D, Da, E, F, G, H, I, Ia, J, K).
Возбудитель отличается уникальным циклом развития, затрудняющим воздействие на него специфических средств, возможностью к персистенции и образованию атипичной инфекции (одновременное присутствие всех стадий цикла размножения хламидий).
ЭТ хламидий имеют овальную форму при размерах 250-500 нм. Элементарные тельца – инфекционная внеклеточная форма, обладающая антигенными свойствами. Цикл развития хламидий происходит только внутри связанных с мембраной клетки вакуолей цитоплазмы, где ЭТ последовательно преобразовывается в более крупные ретикулярные тельца (РТ). РТ обладают полиморфизмом (округлой, овальной, полулунной, коккобациллярной формы), не имеют постоянного размера, величина их от 300 до 1000нм. Не обладают инфекционными свойствами, не имеют нуклеотида, проницаемы для трипсина и разрушаются ультразвуком. Это так называемая – вегетативная («незрелая») внутриклеточная форма, способна к росту и делению и только на этой фазе – эффективно применение антибиотиков, т.к. ЭТ – к ним не чувствительно.
В некоторых исследованиях доказано, что одни антибактериальные средства могут действовать на стадии превращения ЭТ в РТ, другие – во время бинарного деления РТ.
ЭТ (CE) обычно локализуются в крупных внутриклеточных включениях,
РТ (CR) – в образованиях, ограниченных мембраной.
ПАТОГЕНЕЗ
Инкубационный период – 5-30 дней с момента заражения (в среднем 10-14 дней).
Первым этапом инфекционного процесса является адсорбция ЭТ хламидий на плазмалемме чувствительной клетки организма хозяина (действие электростатических сил). Внедрение хламидий происходит путем эндоцитоза в течение 7-10 часов. При этом ЭТ, внедряясь в клетку, использует для роста и размножения клеточную АТФ и через 6-8 часов превращается в РТ. Ранее считали, что хламидии существуют только за счет макроэргических соединений и биологических субстратов клетки хозяина. Однако в настоящее время доказано, что они способны синтезировать в небольших количествах собственную АТФ, отдельные аминокислоты, накапливать гликоген. В процессе роста и деления РТ образуют микроколонии – хламидийные включения (тельца Гальберштадтера-Провачека). В течение 18-24 часов развития они локализованы в цитоплазматическом пузырьке, образованном из мембраны клетки хозяина.
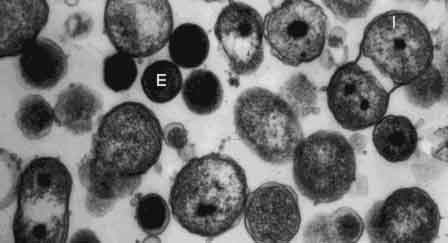
После инфицирования, через 18-22 ч. (РТ превр. в ЭТ)
В микроколониях может содержаться от 100 до 500 ЭТ хламидий. Процесс созревания (промежуточные тельца) и трансформации РТ путем деления в ЭТ занимает 36-42 часа.
Полный цикл репродукции 48-72 часа, завершается разрушением пораженной клетки.
Хламидии могут высвобождаться из инфицированной клетки, сохраняя жизнеспособность клетки (при выходе ЭТ путем экзоцитоза), что приводит к бессимптомному течению.
Освободившиеся ЭТ проникают в новые клетки-мишени.
При возникновении неблагоприятных биохимических условий продолжительность жизненного цикла может значительно увеличиваться.
В результате размножения C. trachomatis в инфицированных эпителиальных клетках развивается воспалительный процесс, выраженность которого зависит от состояния местного и общего специфического и неспецифического иммунитета организма.
После инвазии хламидий образуется комплемент, который приводит к стимуляции гранулоцитов. Эта воспалительная реакция сопровождается локальной гибелью клетки и разрушением ткани, что дополняется высвобождением фосфолипазы А² и простагландинов. Это приводит к отеку и гиперемии слизистой оболочки, нарушению целостности эпителиального слоя с частичной десквамацией эпителия.
Превращение РТ в ЭТ требует не только энергии, но зависит от присутствия биологических субстратов, среди которых важнейшее место занимает аминокислота триптофан. В процессе воспаления лимфоциты выделяют разнообразные цитокины (в т. ч интерферон g), который индуцирует клеточный фермент индоламин-диоксигеназу (ИДО), разрушающий триптофан. Уменьшение триптофана приводит или к гибели хламидий, или к замедлению процессов репликации (клеточного деления), и в эпителиальной клетке начинают накапливаться неинфекционные, неделящиеся РТ. Цикл развития хламидий приостанавливается, но, несмотря на неблагоприятные условия, РТ сохраняют свою жизнеспособность (персистируют). Дальнейшее развитие и исход этого состояния зависят от продолжительности и уровня содержания триптофана. Уменьшение содержания интерферона g и, соответственно, увеличение внутриклеточного пула триптофана приводят к редифференцировке персистирующих форм в инфекционные ЭТ, их выходу из клетки и продолжению инфекционного процесса.
Однако недавно показано, что генитальные хламидии имеют собственный фермент, который позволяет синтезировать триптофан, используя в качестве субстрата индол, в результате чего полного нарушения жизненного цикла может не наступить и образование инфекционных ЭТ будет продолжаться. Продуцентом индола, в частности, может быть микрофлора влагалища. Это важно иметь в виду при наличии ассоциированных влагалищных инфекций (хламидии – анаэробы). При хламидийной инфекции не срабатывает важное звено неспецифической резистентности – фагоцитоз. Взаимодействие хламидий с лимфоцитами и макрофагами не всегда завершается лизисом (циркуляция возбудителя с крово-и лимфотоком, персистенция, приводит к многоочаговости и преобладанию подострых и хронических форм). На стадии РТ хламидии недоступны для антител, лимфоцитов, макрофагов. Доступность этих факторов защиты возможна лишь на стадии ЭТ. Антитела нейтрализуют антилизосомальную активность возбудителя и предотвращают его адгезию к клеткам.
Стадия Эт
Клеточная стенка хламидии состоит из двух мембран (внутренней цитоплазматической и наружной), каждая из которых двойная, что обеспечивает прочность клеточной стенки. Антигенные свойства хламидий определяются внутренней мембраной, которая представлена липополисахаридами (LPS). LPS имеют две антигенные детерминанты: одна – родоспецифическая (реактивной половиной которого является 2-кето-3-дезоксиоктановая кислота - используется при диагностике заболевания иммунофлюоресцентными методами с применением специфических антител), другая – дает перекрестные реакции с некоторыми грамотрицательными бактериями. Во внутреннюю мембрану интегрированы так называемые белки наружной мембраны (Outer membrane proteins – OMP). На основной белок наружной мембраны - Major Outer Membrane Protein (MOMP) приходится 60% общего количества белка. Остальная антигеннная структура представлена белками наружной мембраны второго типа – ОМР 2 (насыщенный цистеином белок, мол. Массой 60 кД).
МОМР и ОМР 2 – определяют видо-и типоспецифичность хламидий, хотя из-за наличия участков с высоким сходством среди видов возможны реакции внутри рода.
Основной белок клеточной мембраны и богатые цистеином другие белки связаны дисульфидными связями.
Обнаружено пять генов дисульфидсвязанных изомераз, возможно играющих роль в реструктуризации цистеинбогатых белков при дифференциации ЭТ в РТ. У Chlamydia trachomatis выявлено 9 генов, кодирующих поверхностные мембранные белки.Главный белок наружной мембраны (МОМР) считается первичным местом взаимодействия с Т-клетками у Chl. Trachomatis. Соответственно, гуморальный иммунный ответ направлен против вариабельных, поверхностно-экспонированных доменов этого белка (P. Mygind, G.Christianssen, et al.,1998). Белок внешней мемраны хламидий-2 (Омр 2) также является участком связывания с иммунной системой для Chl. trachomatis.
Антигены хламидий (по P.-A. Mardh, 1990)
Антиген Химич.состав Примечание Родоспецифический (общий для всех видов хламидий: Chlamydia psittaci, Chlamydia trachomatis, Chlamydia pneumoniae) Липосахарид Три различных антигенных домена Видоспецифический (различен для всех видов хламидий: Chlamydia psittaci, Chlamydia trachomatis, Chlamydia pneumoniae) Белки Более 18 различных компонентов 155 кДа у Chlamydia trachomatis, эпитопы в белке 40 кДа, белок теплового шока hsp-60 Типоспецифический (различен для сероваров Chlamydia trachomatis) Белки Эпитопы в 40 кДа протеине(МОМР), протеине 30 кДа у серотипов А и В Инвазивность хламидий связывают со строением углеводной части главного липополисахарида их внешней мембраны. Так Kuo C, Takahashi N, ( 1996 ) в исследованиях показали, что ведущая роль в инвазивности по отношению к различным клеткам организма принадлежит остаткам маннозы в олигосахаридах, связанных с главным белком внешней мембраны хламидий, которые опосредуют прикрепление хламидий к заражаемым клеткам.
Claman P, Honey L et al, (1997) определяли присутствие главного белка внешней мембраны ( МОМР ) Chl.trachomatis в ткани фаллопиевых труб женщин с бесплодием и с хроническим сальпингитом, а также с билатеральной окклюзией труб. МОМР был обнаружен в образцах из фаллопиевых труб у 11 из 56 пациентов . Средний титр IgG антител против хламидий был значительно выше у женщин с наличием МОМР, чем у пациентов без этого антигена. Ученые сделали вывод, что присутствие МОМР ассоциировано с хроническим сальпингитом и с трубной окклюзией. Задачей исследования Mol BW, Dijkman B, Wertheim P.et al.(1998) явилось определение дискриминационных значений титров к хламидиям в диагностике патологии труб у больных с бесплодием. Общее количество пациентов составило 2729 женщин с субфертильностью в 23 самостоятельных исследованиях, которые привели к важному выводу о том, что диагностическая значимость титров антител к хламидиям методами ELISA, микрофлюоресцентным или иммунофлюоресцентным в диагностике любой трубной патологии вполне сравнимо с результатами ГСГ при диагностике трубной окклюзии.
Исследования S. Hosseinzadex et al. (2003) выявили токсичность ЛПС клеточной стенки хламидий для сперматозоидов. Оценивая подвижность, жизнеспособность и акросомальную реакцию сперматозоидов, авторы обнаружили спермицидные свойства ЛПС.
В составе хламидий имеется так называемый белок теплового шока (БТШ). Персистирующие формы хламидий способствуют образованию высокоиммуногенного БТШ с мол. массой 60 кДА (HSP)60. По антигенному составу хламидийный БТШ гомологичен БТШ человека. В течение инфекционнгого процесса значительно повышается синтез БТШ для защиты от внешних иммунологических защитных механизмов. Иммунный ответ на БТШ организма-хозяина может быть как защитным, так и патологическим. Есть мнение, что образующиеся в организме хозяина противохламидийные антитела, одновременно являются аутоантителами к собственному БТШ-60, который является одним из первых белков, синтезируемых в организме женщины эпителиальными клетками decidua bazalis после оплодотворения. На ранних стадиях беременности, у женщины с хронической хламидийной инфекцией, экспрессия БТШ-60 может реактивировать лимфоциты, сенсибилизированные хламидийным БТШ-60, что приведет к отторжению эмбриона. Этот механизм, а также нарушение трубной проходимости являются ведущими в патогенезе женского бесплодия.
Sziller I, Witkin SS, Ziegert M, Csapo Z, Ujhazy A, Papp Z ( 1998 ) изучали клинические и гистологические корреляции иммунореактивности к Chl.trachomatis и к эпитопам hsp60 среди женщин с эктопической беременностью. Серологический ответ к 13 синтетическим пептидам, соответствующим главным эпитопам hsp60 определяли у 67 женщин с эктопической беременностью и у 45 женщин с самопроизвольными выкидышами. Сальпингит был обнаружен в 43.3% случаев пациенток с внематочной беременностью. Его наличие коррелировало с антителами к двум эпитопам hsp60 ( от 260-271 а.о. и 411-422 а.о.). Антитела к этим двум эпитопам по сравнению с другими 5 эпитопами были выявлены у больных с формированием спаечного процесса в области придатков матки. Антитела к эпитопам 260-271 и 188-199 выявлялись у пациенток с воспалениями органов малого таза. Пациенты с эктопической беременностью имели больший по сравнению с внутриматочной локализацией беременности уровень антител IgG к Chl.trachomatis. Женщины, инфицированные Chl.trachomatis и с положительной иммунореактивностью по отношению к эпитопам hsp60, имели большую частоту сальпингитов и спаек. Наоборот, пациенты, позитивные только по отношению к антителам к Chl.trachomatis не отличались от серонегативных пациентов по этим категориям. Следовательно, индукция спаечного процесса в присутствии Chl.trachomatis определяется наличием антител к hsp60.
Исследование обширного клинического материала провели Kligman I, Grifo JA, Witkin SS ( 1996 ), которые также пришли к выводу, что экспрессия hsp 60 является одним из механизмов, ведущих к локальной активации макрофагов и Т-лимфоцитов и высвобождению цитокинов. Женщины со спаечным процессом имели повышенное количество антител к Chl.trachomatis и hsp60 в перитонеальной жидкости.
Money DM, Hawes SE, Eschenbach DA, ( 1997 ) связывают присутствие hsp60 с развитием перигепатитов и спаечного процесса (проспективное исследование 157 женщин с клиническим диагнозом пельвиолярного воспаления). У 27 женщин лапароскопически обнаружили перигепатит и сальпингит, по сравнению с 46 пациентками с одним только сальпингитом. Антитела к хламидийному hsp60 обнаружили у 67% пациентов перигепатитно-сальпингитной группы и в 28 % случаев в группе с одними сальпингитами. Средний титр был значительно выше в первой группе. По сравнению с женщинами с одним только сальпингитом пациенты с перигепатитом и сальпингитом не имели значительных клинических или микробиологических различий между группами, но демонстрировали значительно большее присутствие спаек и более высокие титры антител к hsp60 белку хламидий.
О нарушениях гормональной функции яичников при инокуляции Chl.trachomatis свидетельствуют экспериментальные данные, полученные на животных моделях. Pal S, Hui W, Peterson EM, de la Maza LM ( 1998 ) исследовали факторы, влияющие на индукцию бесплодия на модели хламидийной инфекции генитального тракта у мышей. Самкам мышей С3Н интравагинально инокулировали различные дозы Chl.trachomatis, в результате чего у них развивался целый ряд клинических проявлений от бесплодия до бессимптомных выкидышей, причем инфекцию в средних и верхних отделах генитального тракта обнаруживали в большем проценте случаев у мышей, инфицированных во время лютеиновой фазы, чем во время фолликулярной. Эти результаты указывают, что быстрое терапевтическое вмешательство может позволить избежать последствий инфицирования хламидиями и предполагает, что гормональные факторы играют решающую роль в патогенезе заболевания.
Также есть данные о влиянии Chl.trachomatis на функции яичников и , в частности, на функцию желтого тела, что может в определенных случаях являться причиной прерывания беременности на ранних сроках.
Таким образом, хламидиоз - это широко распространенное заболевание, ответственное за широкий круг патологии органов и тканей.
Патогенез хламидиоза , как рецидивирующей инфекции, заключается в персистенции, которая может активировать иммунную реактивность. При текущей инфекции бесчисленное число факторов с ингибиторным или модифицирующим эффектом, действующих со стороны организма-хозяина могут вызывать изменения в системе "бактерия -хозяин", позволяющие организму сохранять непродуктивную фазу роста хламидий. Аномальные или персистирующие хламидии распознаются широким рядом клеток иммунной системы. Бесчисленные факторы, связанные с персистенцией хламидий предполагают изначальную генетическую гибкость систем их репродукции, и , следовательно, иммуногенных детерминант , экспрессирующихся на клеточной поверхности.
Взаимодействие хламидий с клеткой-хозяином сопровождается ее гетерогенизацией, формированием новых антигенов, идентичных аллогенным и ксеногенным. При хронической инфекции в организме поддерживается высокий уровень аутосенсибилизации данными антигенами, включающими детерминанты тех клеточных систем, в которых патоген размножается. Повторяющиеся эпизоды инфекции вызывают хроническое воспаление, связанное с патологической стимуляцией иммунной системы продуктами детритного происхождения. С другой стороны, патологическая стимуляция иммунной системы, с развитием различных аутоиммунных реакций инициируется и поддерживается циркуляцией хламидийных антигенов, имеющих общие эпитопы с рядом антигенов человеческого организма. Это белки теплового шока, а также L7 (один из рибосомальных белков, наиболее часто взаимодействующих с антителами при ревматических аутоиммунных заболеваниях). Другая часть общего патофизиологического механизма хламидийной инфекции обусловлена реакциями защитных систем организма-хозяина, благодаря которой при хламидийной инфекции развивается воспаление, приводящее к повреждению тканей и развитию различных осложнений. На поражение хламидиями, эпителиальные клетки, реагируют up-регуляцией экспрессии мРНК и секрецией провоспалительных цитокинов IL8, GRO-альфа , GM-CSF и IL6. Важно, что в противоположность быстрой и непродолжительной индукции цитокинов, следующей после инфекции другими инвазивными бактериями, эпителиальный ответ на хламидии откладывается на 20-24 часа после инфицирования, т.е. на время длительности жизненного цикла хламидий и требует белкового синтеза. При этом повышенная секреция провоспалительных цитокинов может быть опосредована IL-1-альфа, который высвобождается при лизисе инфицированных эпителиальных клеток и может повышать воспалительный ответ путем стимулирования цитокиновой продукции неинфицированными соседними клетками. По сходному цитокиновому механизму обеспечивается инициирование и протекание воспалительного процесса в суставах, когда Chl.trachomatis стимулирует синовиоциты к продукции IL-6, TGF-beta, GMCSF, а IL-1 бета повышает продукцию IL-6 и GMCSF инфицированных клеток.
Защита слизистых оболочек обеспечивается совокупностью различных факторов (нормальная микрофлора, секреторные и сывороточные иммуноглобулины, бактерицидные продукты (комплемент, лизоцим, лактоферрин и др.)).
Важную роль во взаимодействии хламидийной инфекции с иммунной системой организма-хозяина играет синтез интерферона-гамма. Показано, что при достаточной стимуляции интерфероном-гамма цитотоксических лимфоцитов происходит лизис инфицированных хламидиями клеток, из которых выходят во внеклеточную среду незрелые и нежизнеспособные промежуточные формы хламидий, что и лежит в основе освобождения организма от инфекции. Следующим критическим моментом освобождения организма от инфекции является поляризация Т-клеточного ответа макрофагами, опосредованная как интерфероном-гамма, так и IL4 , продукция которого ведет к ответу Th1-типа, способного уничтожить хламидийную инфекцию. Исходно организм располагает защитными механизмами, эффективно уничтожающими хламидии. Но эти механизмы достаточно сложны, многофакторны и пути дальнейшего распространения инфекции зависят от состояния макрофагальной функции, иммунокомпетентных клеток , способа переключения цитокинового ответа по Th1 или Th3 типу, уровней секреции цитокинов и многих других факторов. К наиболее значимым антихламидийным факторам иммунитета, в последнее время, помимо интерферонов, относят TNF (фактор некроза опухолей), IL-1. (Morrison R.P., 2003).
Основные факторы распространения хламидиоза.
- Социальные факторы:
- алкоголизм, наркомания,
- низкий уровень жизни,
- увеличение числа разводов.
- Демографические факторы:
- молодые люди в возрасте 15-30 лет
- (хламидийная инфекция среди молодых женщин встречается в 5 раз чаще, чем у мужчин этой возрастной группы);
- снижение возраста полового созревания,
- увеличение возраста вступления в брак.
- Экономические факторы:
- международный туризм (в том числе секс-туры).
- Поведенческие факторы:
- раннее начало половой жизни,
- количество половых партнеров,
- недавняя смена полового партнера
- нетрадиционные половые контакты
Механизмы передачи инфекции.
- Контактный – реализация половым и неполовым (контактно-бытовым) путями.
- Передача хламидий при сексуальном контакте с инфицированным больным происходит в 32-40% случаев.
- Вертикальный – антенатальным, интранатальным путями.
Восходящая хламидийная инфекция, пути передачи:
- каналикулярный, - через цервикальный канал, полость матки, маточные трубы, на брюшину и органы брюшной полости;
- лимфогенный – по лимфатическим капиллярам;
- гематогенный – о чем свидетельствует наличие экстрагенитальных поражений (глотка, суставные сумки).
В распространении хламидий могут участвовать сперматозоиды, использование внутриматочных средств, различные гинекологические вмешательства.
Инфекция на фоне ВМС.
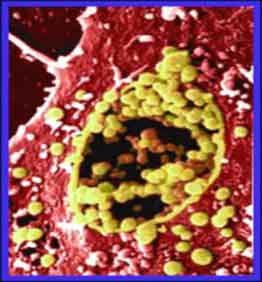
Элементарные тельца хламидий (ярко зеленый цвет) в человеческой сперме (Courtney S.)
КЛИНИКА
Классификация по МКБ-10
- Хламидийная инфекция нижних отделов мочеполового тракта:
- цервицит;
- цистит;
- уретрит;
- вульвовагинит.
- Хламидийная инфекция органов малого таза и других мочеполовых органов:
- эпидидимит;
- воспалительные заболевания органов малого таза у женщин;
- орхит.
- Хламидийная инфекция аноректальной области.
- Хламидийный фарингит.
- Хламидийная инфекция другой локализации.
Хламидиоз может протекать в виде острого, подострого, хронического заболевания, но на современном этапе преобладает бессимптомное течение. Так клинические симптомы отмечаются лишь в ¹/³ случаев УХ.
- слизистые, слизисто-гнойные выделения из цервикального канала и/или влагалища;
- боли в нижней части живота;
- посткоитальные и межменструальные кровянистые выделения;
- хронические тазовые боли;
- дизурия;
- диспареуния.
Помимо асимптомного течения УГХ, в настоящее время, отмечено увеличение частоты рецидивов УГХ. По данным различных авторов от 2-50% (Баткаев Э.А., Рюмин Д.В., 2003; Кунцевич Л.Д., Комов Н.Н., 2004).
ОСЛОЖНЕНИЯ..
- ВЗОМТ
- Синдром Фитца-Хью Куртиса
- Бесплодие.
- Внематочная беременность.
- Привычное невынашивание беременности (13-25%).
- Преждевременный разрыв плодного пузыря.
- Преждевременные роды.
- Послеродовый эндометрит.
- Хориоамнионит, плацентит.
- Внутриутробное инфицирование плода (8-12%), внутриутробная гибель плода.
- Неудачи в попытках ЭКО.
Спайки между печенью и париетальной брюшиной у женщины с острым перигепатитом, вызванным Chlamydia trachomatis (синдром Фитц-Хью-Куртиса) (Х. Хансфилд)
Эутопическая беременность у женщины с диагностированным УГХ
ДИАГНОСТИКА УХ.
В настоящее время не существует лабораторного метода, позволяющего избежать как ложноположительных, так и ложноотрицательных результатов.
Необходимо учитывать предел чувствительности и специфичности каждого метода.
Важна комплексная лабораторная диагностика (для того, чтобы выявить возбудителя, определить стадию заболевания, обосновать необходимость назначения антибактериальных препаратов). Т.О. "золотой стандарт" в настоящее время -комбинация методов с и использованием сертифицированных диагностических реагентов и тест-систем.
Методы диагностики.
Иммунофлюоресцентный метод — прямая, непрямая иммунофлюоресценция (ПИФ, НПИФ) ПИФ - определение антигена с использованием моноклональных антител (сокращение ложноположительных результатов) против липополисахаридов (ЛПС) или основных белков наружной мембраны возбудителя. Выявляет жизнеспособные хламидии и их франменты. Чувствительность – 90-95%; Специфичность – 98%. Регламентирован МЗ РФ. Достоинство метода: быстрота, непосредственное определение возбудителя в небольшом объеме исследования, недостаток - ложноотрицательные результаты при гонорейно-хламидийном процессе, зависимость от человеческого фактора.
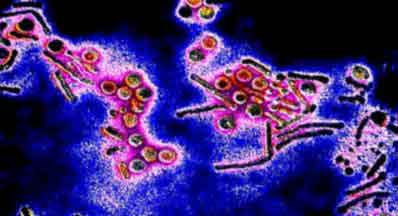
Обнаружение C.trachomatis методои ИФА
Элементарные телца C. trachomatis светятся зеленовато-желтым цветом. Эпителиальные клетки – хозяина характеризуются красным цветом. (Х. Хансфилд)
Культуральный метод – выделение жизнеспособного возбудителя на культуре клеток, обработанных различными антиметаболитами. Специфичность – до 100%; чувствительность – 80%. Референс-метод при оценке эффективности антибактериального лечения, является стандартом, с которым сравнивают вновь разработанные методы диагностики. Достоинство метода - достаточно обнаружения одной клетки с типичным цитоплазматическими включениями, определение чувствительности к антибиотикам. Недостаток -высокая стоимость, трудоемкость, возможность гибели хламидий при транспортировке.
Молекулярные методы:
- метод гибридизации нуклеиновых кислот (ДНК-зонды) – выделяют суммарную ДНК. Чувствительность и специфичность – 80 и 100% соответственно. Недостаток метода - высокая стоимость, риск переноса загрязнений между образцами и реагентами.
- методы амплификации нуклеиновых кислот (ПЦР, ЛЦР), рибосомальная РНК амплификация (ТМА – “transcription-mediated- amplification”).
ПЦР – многократно повторяющиеся циклы синтеза (амплификация) специфической области ДНК-мишени в присутствии ДНК-полимеразы. Высокая и регулируемая специфичность, высокая чувствительность, позволяет определять жизнеспособные и нежизнеспособные микроорганизмы.
На основании амплификационных методик разработаны мочевые тесты, довольно удобные для применения в амбулаторной практике.
Иммуноферментный анализ (РИФ-АГ). Чувствительность и специфичность составляет 65-70% и 90-100% соответственно. В России данный метод не получил распространения.
Цитоскопические методы (Окраска по Романовскому-Гимзе, раствором Люголя) - чувствительность этого метода невысокая 15—30%
Серологические методы по результатам серологических исследований сложно сделать вывод о наличии активной хламидийной инфекции, так как антитела появляются не сразу после инфицирования, их колебания не всегда коррелируют с клиническим статусом больного, могут сохраняться длительное время после эрадикации
C.trachomatis. Это обстоятельство лишает данный метод юридической силы и фактической пользы. Применение может носить лишь вспомогательный или дополнительный характер. Но возможно использование данного метода при одновременном исследовании к родоспецифическому ЛПС C.trachomatis и БТШ 60 (HSP 60) хламидий (Т.А. Скирда и соавт., 2004).
ДИФФЕРЕНЦИАЛЬНЫЙ ДИАГНОЗ
Проводится со специфическими урогенитальными инфекциями, обусловленными патогенными и условно-патогенными микроорганизмами на основании клинико-лабораторных критериев.
ЛЕЧЕНИЕ
Лечение хламидиоза урогенитального тракта — сложная и трудная задача. Она усугубляется ассоциацией хламидиоза у многих больных — до 50 %, по мнению большинства авторов, с другими заболеваниями, передаваемыми половым путем. В результате этого возникает иммунная перестройка организма, выявляемая иммунобиологическими исследованиями. Помимо этого клиническая картина инфекции характеризуется нередко вялым или латентным течением, в связи с чем патологический процесс длительное время остается нераспознанным, а запоздалое лечебное вмешательство оказывается недостаточно эффективным. Именно поэтому, несмотря на увеличение количества антибактериальных препаратов, претендующих на роль наиболее эффективного средства в терапии хламидиоза, проблема достаточно быстрого и гарантированного излечения этого заболевания остается актуальной по сей день. Длительное время основными средствами в лечении хламидиоза являлись препараты тетрациклинового ряда. Однако они требуют довольно длительного приема, что повышает риск появления тяжелых побочных действий. Помимо этого, тетрациклины противопоказаны при беременности. После применения хинолоновых антибиотиков, таких, как таривид, максаквин часты рецидивы. Макролиды относятся к числу активных противохламидийных препаратов.
Из группы макролидов наше внимание привлек кларитромицин — полусинтетический кислотоустойчивый антибиотик. Кларитромицин превосходит эритромицин по фармакокинетике, о чем свидетельствуют лучшее его всасывание в кишечнике, более высокая концентрация в плазме и длительный период полувыведения, а также усиленное проникновение в ткани. Противомикробная активность препарата in vivo усиливается за счет благоприятного характера его распределения с накоплением в тканях и органах в концентрациях, превышающих таковые в крови. Кроме того, важным аспектом механизма действия кларитромицина является способность к проникновению внутрь клетки, которая и обеспечивает ему преимущество при лечении инфекций, вызванных микроорганизмами, размножающимися внутри клеток хозяина, в частности хламидиоза. В отношении 9 клинических и 2 лабораторных штаммов Chlamydia trachomatis кларитромицин примерно в 8 раз активнее эритромицина, что обеспечивает более удобное двукратное применение препарата в амбулаторной практике. Однако наибольший интерес, на наш взгляд, представляет заключение итальянских ученых, изучавших влияние кларитромицина на иммунную систему человека. В ходе своих исследований они пришли к выводу, что в результате терапии кларитромицином не только не отмечается угнетающего влияния на иммунный ответ, а, напротив, происходит активация фагоцитарно-макрофагальной системы и ряда ферментов, участвующих в разрушении патогенных бактерий [4]. Этот факт указывает на уникальное, присущее данному антибиотику иммуностимулирующее свойство. Еще в 1988 году в Японии проводилось изучение эффективности кларитромицина у группы больных урогенитальными инфекциями, находившихся под наблюдением ряда клиник и практикующих врачей. По объединенным данным, из 204 больных хламидийным уретритом, получавших клацид в суточной дозе от 200 до 900 мг в течение 3—14 дней, клинический эффект был прекрасным или хорошим у 188, т. е. у 92%. Кроме того, из 116 больных уретритом, вызванным уреаплазмой, излечение было достигнуто у 99, т. е. у 85%.
Наиболее обосновано применение кларитромицина в виде таблеток пролонгированного действия (Клацид СР), который обладает наиболее высокой активностью в группе в отношении Chlamydia trachomatis (МПК 90 = 0.007 мг/л), этот препарат высоко активен в отношении других патогенов, часто сопутствующих хламидийной инфекции.
Клацид СР 500 мг 1 раз в день – 7 дней
или
Клацид 250 мг 2 раза в день – 7 дней
Клацид СР (кларитромицин) – полусинтетический кислотоустойчивый антибиотик, представитель класса макролидов с 14-членным лактонным кольцом.
Фармакологической особенность - способность преодолевать клеточные мембраны и накапливаться в клетках макроорганизма, в том числе и в иммунокомпетентных клетках.
Способность к внутриклеточной кумуляции, создавая при этом высокие концентрации, определяет выраженную бактерицидную активность в отношении внутриклеточных возбудителей: хламидий, микоплазм, уреаплазм, легионелл, листерий, а так же стрептококков, стафилококков, аэробных грамотрицательных микроорганизмов типа гемофильной палочки, моракселлы, бордателлы. Кларитромицин и его метаболиты проникают в ткани и жидкости организма, причем их концентрация в тканях намного превышает таковые в плазме. Клацид СР оказывает быстрое, мощное и в тоже время пролонгированное действие в сравнении с другими макролидами. Кларитромицин накапливается в лимфоцитах, лейкоцитах, макрофагах, в результате чего создается высокая тканевая концентрация препарата в пораженном органе.
Высокая клиническая эффективность кларитромицина связана с его противовоспалительным эффектом и воздействием на функциональную активность фагоцитов периферической крови. (обусловлено выраженной антиоксидантной активностью и способностью снижать процессы окислительного метаболизма в фагоцитах, понижая образование супероксидного иона).
Клацид СР активен в отношении внутриклеточных микроорганизмов:
- Chlamydia trachomatis, Chlamydia pneumoniae,
- Ureaplasma urealyticum, Mycoplasma pneumoniae,
- Legionella pneumophila;
- грамположительных бактерий: стрептококков, в том числе S. рneumoniae, стафилококки, Listeria monocytogenes, Corynebacterium spp.;
- грамотрицательных бактерий: Haemophilus influenzae, Haemophilus ducreyi, Bordetella pertussis, Pasteurella multocida, Moraxella catarrhalis, Neisseria gonorrhoeae, Neisseria meningitidis, Borrelia burgdorferi, Campylobacter spp.
- в отношении некоторых анаэробов: Eubacterium spp., Peptococcus spp., Propionibacterium spp., Clostridium perfringens, Bacteroides melaninogenicus; также в отношении Toxoplasma gondii, Mycobacterium spp. (кроме Mycobacterium tuberculosis).
Клацид СР влияет на процессы иммунного реагирования макроорганизма через изменение синтеза моноцитами и макрофагами важнейших медиаторов иммунного ответа ( фактор некроза опухоли, интерлейкины, колониестимулирующий фактор и др.).В отношении внутриклеточных возбудителей кларитромицин примерно в 8 раз активнее эритромицина. Проведенные международные исследования минимальных ингибирующих концентраций (МИК 90) антибиотиков-макролидов подтверждают преимущество назначения кларитромицина при УГХ. Этот показатель для кларитромицина равен 0,06; азитромицина – 0,1; рокситромицина – 0,25.
В сравнении с азитромицином дает более высокие концентрации в крови и менее длительные субингибирующие концентрации, что уменьшает появление резистентных штаммов
Кларитромицин дает наименьшее число рецидивов при сравнении с эритромицином, доксициклином, офлоксацином. Кроме того, кларитромицин является ингибитором повторного роста бактерий, что обуславливает выраженный постантибиотический эффект.
В Европейский стандарт по лечению хламидийной инфекции включен кларитромицин.
Клацид СР “ДАБЛ-БАБЛ” имеет наиболее высокую активность в отношении других возбудителей урогенитальных инфекций, что важно при микстинфекциях.
По сравнению с другими препаратами, применяемыми для лечения хламидийной инфекции, кларитромицин лучше переносится пациентами благодаря значительно менее выраженным побочным эффектам (European STD guidelines)ОЦЕНКА ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ
Первый контроль – сразу после завершения лечения (исключая иммунологические методы диагностики возбудителей). У женщин контрольные исследования проводятся во время трех ближайших менструальных циклов. Также 3 месяца на клинико-лабораторном контроле находятся их половые партнеры.
Иммунологические методы диагностики проводят через 4 недели после окончания лечения, далее по показаниям.
Рекомендовать воздержание от половых контактов до завершения лечения и получения отрицательных результатов.
Через несколько месяцев после окончания терапии, во избежание случаев реинфекции, целесообразно повторное исследование лиц группы риска (подростки, молодые женщины).
При наличии полового контакта с больным хламидийной инфекцией в течение предшествующих 60 суток проводить обследование и лечение.
ПРОГНОЗ
При своевременном выявлении и адекватном лечении – благоприятный.
Литература.
- Department of health and human services, Centers for Disease Control and Prevention. Sexually Transmitted Diseases Treatment Guidelines, 2006. Morbidity and Mortality Weekly Report Recommendations and Reports August 4, 2006 / Vol. 55 / No. RR-11.
- Jeffrey F. Peipert, Genital Chlamydial Infections, NEJM, 2003, 15 с.
- Wiesenfeld H.C.,Hillier S.L., et al. Genital Infections and endometritis. Obstet Gynecol, 2002, Sep; 100(3):456-63.
- А.Л. Тихомиров, С.И. Сарсания. Современные подходы к лечения воспалительных заболеваний женских половых органов. Методические рекомендации, М., 2005. 32 с.
- В.А. Аковбян. Урогенитальная инфекция: 25 лет спустя. ГУ НИИЭМ им. Н.Ф. Гамалеи РАМН. М. 2005.
- Э.А. Баткаев. Этиотропная терапия урогенитального хламидиоза // Клин. дерматол. и венерол. 2003. №3. С 13-19.
- Е.Г. Бочкарев. Лабораторная диагностика хламидийной инфекции. Институт аллергологии и клинической иммунологии. Клинические лекции. М. 2005. 10с.
- Кубанова А.А., В.И. Кисина. Рациональная фармакотерапия заболеваний кожи и инфекций, передаваемых половым путем. Руководство для практикующих врачей. Том VIII. М., 2005. C. 542-565.
Хантер Хансфилд. Заболевания, передающиеся половым путем. Цветной атлас-справочник, М., Бином, 2004. 293 с. А.И. Якубович, А.Р. Корепанов. Урогенитальный хламидиоз. Иркутск. 2007. 108 с.
Октябрь 2007 г.