Опубликовано в журнале:
ВОПРОСЫ СОВРЕМЕННОЙ ПЕДИАТРИИ /2010/ ТОМ 9/ № 2Безопасность мелоксикама при лечении ювенильного артрита у детей
Е.С. Жолобова, З.В. Гешева, О.Ю. Конопелько, А.В. Мелешкина, О.С. Розвадовская, Т.Н. Сергеева
Московская медицинская академия им. И.М. СеченоваВ исследовании проводилась оценка безопасности мелоксикама (Мовалис) при длительном применении у детей с ювенильными артритами (ЮА). Были проанализированы в динамике клинико-эндоскопические данные 50 больных с ЮА, по разным причинам переведенных с терапии диклофенаком на мелоксикам. Проведена оценка гепатотоксичности мелоксикама в сравнении с другими нестероидными противовоспалительными препаратами (НПВП) - диклофенаком и нимесулидом. В ходе исследования было отмечено, что применение мелоксикама в качестве противовоспалительной терапии ЮА снижает риск развития эрозивных и язвенных поражений желудочно-кишечного тракта. Частота гепатотоксичности на фоне приема НПВП составила 7,2%. Реже всего трансаминазы повышались у больных, лечившихся мелоксикамом.
Ключевые слова: дети, ювенильный ревматоидный артрит, ювенильный хронический артрит, нестероидные противовоспалительные препараты, гастротоксичность, гепатотоксичность.
Safety of meloxicam in treatment of juvenile arthritis in children
Ye.S. Zholobova, Z.V. Gesheva, O.Yu. Konopel'ko, A.V. Meleshkina, O.S. Rozvadovskaya, T.N. Sergeyeva
I.M. Sechenov Moscow Medical AcademyThe study estimated the safety of meloxicam in prolonged treatment of children with juvenile arthritis (JA). Clinical data and results of endoscopy of 50 patients with JA were analyzed. All patients were switched from diclofenac to meloxicam by different reasons. An estimation of hepatotoxicity of meloxicam compared to other non-steroidal anti-inflammatory drugs (NSAIDs) - diclofenac and nimesulid, was performed. The results of a study show that treatment with meloxicam decreases a risk of gastrointestinal adverse events in patients with JA. Hepatotoxicity rate of NSAIDs was 7,2%. Patients treated with meloxicam had lowest rate of transaminases increase.
Key words : children, juvenile rheumatoid arthritis, juvenile chronic arthritis, NSAIDs, gastrotoxicity, hepatotoxicity.
Нестероидные противовоспалительные препараты (НПВП) широко используются в различных областях медицины, благодаря уникальному сочетанию противовоспалительного, жаропонижающего и анальгетического действия. Спецификой использования НПВП при ювенильных артритах является необходимость длительного, регулярного приема лекарственных средств. Важно помнить, что НПВП оказывают только симптоматический эффект, не влияя на патогенез заболевания. Они не способны приостановить прогрессирование ревматоидного процесса, предотвратить развитие деформаций суставов. Однако облегчение, которое приносят НПВП, объясняет широкое их применение у детей с ревматическими заболеваниями, особенно во время проведения дифференциальной диагностики ювенильных артритов, при подборе базисной противоревматической терапии, во время обострений суставного синдрома. При достижении стойкой клинико-лабораторной ремиссии необходимости в продолжении использования НПВП нет [1-3].
Ювенильный артрит может дебютировать в любом возрасте, в том числе и на первом году жизни. В то же время круг НПВП, разрешенных в детской практике, ограничен. Даже такой широко используемый препарат как диклофенак официально зарегистрирован для использования у детей в возрасте 6 лет и старше. У детей с первого полугодия жизни в России разрешен к применению только ибупрофен. Кроме того, практически нет исследованийпо сравнительной оценке эффективности и частоте возникновения побочных эффектов НПВП у детей, что позволило бы официально расширить возраст применения препаратов данной группы. Исключением является двойное слепое рандомизированное исследование по изучению эффективности и частоты развития побочных эффектов на фоне применения мелоксикама в сравнении с напроксеном [4]. В многоцентровое исследование включали пациентов с ювенильным артритом в возрасте от 2 до 16 лет в краткосрочном (3 мес) и долговременном (12 мес) режиме назначения НПВП. Исследование показало сопоставимую эффективность препаратов, а частота некоторых нежелательных побочных явлений при использовании мелоксикама оказалась даже ниже, чем в группе с напроксеном [4].
К наиболее частым побочным эффектам терапии НПВП относят гастротоксичность, которая часто встречается в детском возрасте, однако редко приводит к драматическим событиям, таким как перфорация язвы, желудочно-кишечное кровотечение. В то же время в ряде ранее проведенных исследований было показано, что частота эрозивных и язвенных поражений слизистой оболочки верхних отделов ЖКТ на фоне применения диклофенака у детей с ювенильным артритом достигает 29%, а частота развития гастродуоденитов - 80% [5-8]. Значительно реже применение НПВП сопровождается появлением признаков гепатотоксичности, крайне редко - нефро- и гематотоксичности, редко регистрируются и аллергические реакции [9].
Профилактика гастропатий, возникающих при применении НПВП, является одной из наиболее актуальных проблем безопасности применения препаратов этой группы. Она заключается в замене неселективных НПВП на блокаторы циклооксигеназы (ЦОГ) 2, а также в использовании антисекреторной терапии. К НПВП селективного действия, разрешенным в детской практике, относятся нимесулид и мелоксикам. Однако применение нимесулида не только в детском возрасте, но и вообще в медицинской практике вызывает массу дискуссий. В США, Канаде, Великобритании, Австрии - препарат не допущен к регистрации по причине гепатотоксичности, в Японии, Израиле и Испании - установлен запрет на использование нимесулида [9, 10]. Мелоксикам является селективным ингибитором ЦОГ-2, и в целом ряде исследований у взрослых больных показана относительно низкая частота побочных эффектов этого препарата, по сравнению с другими НПВП. В Российской Федерации мелоксикам (Мовалис) разрешен для применения у детей с 12-летнего возраста, несмотря на доказанный благоприятный профиль его эффективности и безопасности у детей младшего возраста [4]. В странах Северной Америки мелоксикам разрешен к применению у детей с возраста 2-х лет.
Ниже представлены результаты изучения безопасности мелоксикама при длительном применении у детей с ювенильными артритами. Исследование выполнено на базе ревматологического отделения клиники детских болезней ММА им. И. М. Сеченова. Оценка эффективности и безопасности НПВП проводилась путем изучения в динамике клинико-эндоскопических данных у 54 больных с ювенильным артритом, по разным причинам переведенных с терапии диклофенаком на мелоксикам (Мовалис, Boehringer Ingelheim Pharma, Германия). В связи с прекращением приема препарата (отсутствие в аптечной сети по месту жительства) выбыли из исследования 4 пациента. Соответственно, при анализе использовались результаты обследования 50 детей, получавших мелоксикам в течение 6-12 мес. В ходе исследования была проведена и оценка гепатотоксичности мелоксикама в сравнении с другими НПВП. Группа пациентов, получавших мелоксикам, включала 54 ребенка, диклофенак - 100, нимесулид - 27 больных ювенильным артритом. Гепатотоксичность определялась как повышение аланин-аминотрансферазы (АЛТ) и аспартат-аминотрансферазы (АСТ) более чем на одну норму или изменения со стороны печени, выявленные в ходе ультра звукового обследования.
В группе детей, получавших мелоксикам, мальчиков было 21 (42%), девочек - 29 (58%), средний возраст детей на момент исследования составил 13 лет (разброс от 4 до 17 лет). Диагноз ювенильного ревматоидного артрита (ЮРА) верифицирован у 27 (54%) детей, в том числе системный вариант - у 5 (9%), суставной - у 22 (44%). Диагноз ювенильного спондилоартрита (ЮСА) был установлен у 11 (22%), ювенильного хронического артрита (ЮХА) - у 12 (24%) детей. В среднем, заболевание дебютировало в возрасте 5 лет (от 1,5 до 15 лет). Средняя продолжительность заболевания составила 7 лет (от 3 мес до 15 лет). Возраст детей, на момент назначения мелоксикама в среднем составил 12 лет (табл. 1).
Таблица 1. Характеристика пациентов с ювенильными артритами, получавших мелоксикам
Показатель ЮРА (системный вариант),
n = 5ЮРА (суставной вариант),
n = 22ЮСА,
n = 11ЮХА,
n = 12Мальчики/девочки, абс. 3/2 5/17 9/2 4/8 Возраст начала заболевания, годы 6,2 ± 2,0 6,2 ± 3,0 7,7 ± 3,0 8,6 ± 2,6 Продолжительность заболевания, годы 6,5 ± 2,5 7,2 ± 2,8 6,0 ± 2,0 6,7 ± 3,3 Настоящий возраст, годы 11,0 ± 2,0 12,0 ± 3, 0 13,5 ± 2,5 12,5 ± 2,5 Примечание.
Количественные признаки представлены в виде среднего арифметического значения ± стандартное отклонение.
ЮРА - ювенильный ревматоидный артрит; ЮСА - ювенильный спондилоартрит; ЮХА - ювенильный хронический артрит.До назначения мелоксикама 1 степень активности ювенильного артрита отмечалась у 12 (24%) детей, 2-я степень - у 17 (34%), 3-я степень - у 8 (16%) пациентов. В 13 (26%) случаях повышение лабораторной активности болезни (повышение СОЭ, уровня С-реактивного белка, ревматоидного фактора и т. д.) не отмечалось. По данным рентгенологического обследования суставов, деструктивные изменения разной степени выраженности были выявлены у 44 (88%) больных. Они проявились остеопорозом (I анатомическая стадия) у 33 (67%) детей, незначительным сужением щелей и единичными эрозиями суставной поверхности (II анатомическая стадия) - у 9 (17%), выраженным сужением щелей, множественными эрозиями (III анатомическая стадия) - у 3 (6%) больных. Серонегативны по ревматоидному фактору были 48 (97%) больных, серопозитивны - 2 (3%). Суставной синдром проявлялся моноартритом у 6 (12%), олигоартритом - у 23 (48%), полиартритом - у 21 (42%) пациентов.
Оценка предшествующей терапии показала, что 47 (94%) детей лечились различными формами диклофенака. Глюкокортикоидные препараты (ГКС) в пероральной форме получали 5 (10%) больных, пульс-терапию метилпреднизолоном - 10 (20%). Внутрисуставно ГКС вводились 28 (56%) пациентам. Внутривенное введение иммуноглобулина проводилось 6 (12%) пациентам, инфликсимаба - 2 (4%) больным. В качестве базисной терапии применялись: метотрексат - у 23 (46%) детей, сульфасалазин - у 15 (30%), гидроксихлорохин - у 4 (8%), циклоспорин - у 3 (6%), лефлуномид - у 1 (2%) больного. Причины перевода пациентов на прием мелоксикама представлены в табл. 2. У 3 детей в связи с уже имеющимися признаками гастродуоденита мелоксикам был назначен в качестве первого препарата из группы НПВП. Жалобы на боли в животе предъявляли 17 (34%) детей. При физикальном обследовании обложенность языка отмечалась у 46 (93%), пальпаторная болезненность в эпигастрии - у 27 (55%) пациентов. Отягощенный наследственный анамнез по заболеваниям ЖКТ имел место в 9 (18%) случаях.
Таблица 2. Причины назначения мелоксикама
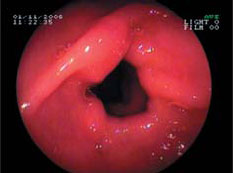
Причины Число пациентов, абс. Жалобы на боли в эпигастрии 17 Клинико-эндоскопические проявления гастродуоденита 39 Эрозивно-язвенные повреждения ЖКТ 11 Повышение уровня трансаминаз 3 Непереносимость диклофенака 3 Неэффективность предыдущей терапией другими НПВП 7 Атопический дерматит 1 До назначения мелоксикама эзофагогастродуоденоскопия (ЭГДС) была выполнена у 39 (78%) детей, в том числе у 36 больных, ранее получавших диклофенак. У последних при проведении ЭГДС терминальный эзофагит был обнаружен у 25 (69%) больных, антральный гастрит - у 36 (100%), бульбодуоденит - у 31 (86%), дуоденогастральный рефлюкс - у 17 (47%), эрозивные и язвенные повреждения слизистой оболочки желудка и 12-перстной кишки - у 11 (30%) пациентов (рис. 1, 2). Инфицированность Helicobacter pylori (Hp) выявлена в 10 (28%) случаях. Таким образом, гастрит диагностирован у всех 36 детей, получавших диклофенак. Среди детей с эрозивными и язвенными повреждениями слизистой оболочки ЖКТ преобладали дети с суставной формой ЮРА - 7 (64%), длительно принимавшие НПВП.
Рис. 1. Эрозия луковицы 12-перстной кишки у больного с ЮСА
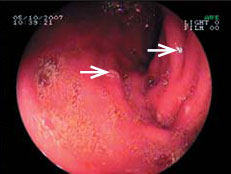
Рис. 2. Гастродуоденит, отек слизистой оболочки антрального отдела желудка у больного с ЮРА, Нр-ассоциированным гастритом
После проведения антисекреторной и эрадикационной терапии (в случае Нp-ассоциированного гастрита) мелоксикам был назначен в дозе 7,5 мг/сутки у детей с массой тела до 35-40 кг и 15 мг/сутки - у детей с массой тела детей с массой тела > 40 кг.
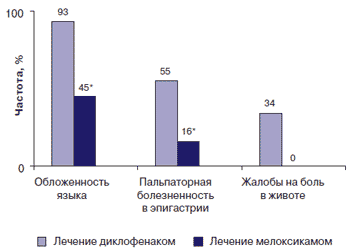
Эффективность и частота возникновения нежелательных явлений в результате терапии, включавшей мелоксикам, оценивались через 6-12 мес. от начала лечения. Через 6 мес жалобы на боли в животе не предъявлял ни один пациент, при физикальном обследовании обложенность языка отмечалась у 22 (45%), а пальпаторная болезненность в эпигастрии - у 8 (16%) детей (рис. 3).
Рис. 3. Динамика клинических проявлений поражения ЖКТ на фоне терапии у детей с ювенильным артритом
 Примечание.
Примечание.
* p < 0,05 - по сравнению с показателем в группе детей, получавших диклофенак.Полное клинико-лабораторное обследование в условиях стационара через 6-12 мес было проведено 32 пациентам.
В связи с отсутствием жалоб на боли в животе и физикальных признаков поражения ЖКТ (отсутствие обложенности языка, пальпаторной болезненности) необходимость в проведении повторной ЭГДС у большинства больных отсутствовала. Повторная ЭГДС была проведена 16 детям, в том числе 7 из 11 с эрозивными и язвенными поражениями слизистой оболочки желудка и двенадцатиперстной кишки, выявленными на фоне лечения диклофенаком при проведении первой ЭГДС. Все повторно обследованные дети продолжали получать в качестве НПВП мелоксикам. Как видно из табл. 3, эрозивные и язвенные повреждения слизистой оболочки желудка и двенадцатиперстной кишки при повторном обследовании не были обнаружены ни у одного больного. Однако частота выявления гастродуоденита, эзофагита и дуоденогастрального рефлюкса практически не изменилась. По-видимому, развитие этих изменений слизистой оболочки верхних отделов ЖКТ у пациентов, принимающих мелоксикам, зависит не только от селективности НПВП, но и от других факторов риска.
Таблица 3. Результаты эндоскопического обследования детей с эрозивными и язвенными поражениями слизистой оболочки желудка и 12-перстной кишки до и после назначения мелоксикама
Данные ЭГДС Исходно (n = 11), абс. (%) После лечения (n = 7), абс. (%) Терминальный эзофагит 9 (80) 7 (100) Антральный гастрит 11 (100) 6 (85) Бульбодуоденит 11 (100) 6 (85) Дуоденогастральный рефлюкс 6 (55) 3 (43) Эрозивно-язвенные повреждения 11 (100) 0 (0) Отсутствие жалоб на боли в эпигастрии, уменьшение выраженности обложенности языка и пальпаторной болезненности в эпигастрии, а также отказ пациентов от проведения ЭГДС не позволили провести контрольное эндоскопическое обследование в полном объеме. Вместе с тем, у детей было отмечено уменьшение клинических проявлений НПВП-гастропатий, а следовательно, снизился риск развития эрозивных и язвенных поражений слизистой оболочки желудка и двенадцатиперстной кишки. Представляет интерес также и то, что у одного ребенка со стойким дерматитом на все возможные препараты группы НПВП мелоксикам не вызвал обострения этого заболевания.
Для изучения гепатотоксичности НПВП был обследован 181 ребенок с ювенильным артритом, из них 115 (64%) девочек и 66 (36%) мальчиков. Возраст детей на момент исследования составлял от 3 до 16 лет, средний возраст - 11,2 лет. Длительность заболевания в среднем составляла 4,4 года. Продолжительность непрерывного приема НПВП варьировала в диапазоне от 2 нед до 3 лет. ЮРА был диагностирован у 107 (59%) детей, ЮХА - у 49 (27%), ЮСА - у 13 (7%), реактивный артрит (РеА) - у 9 (5%), псориатическая артропатия (ПсА) - у 2 (1%) пациентов.
Особенностью фармакологического анамнеза обследованных детей являлось то, что из 181 ребенка - 105 (58%) помимо НПВП получали базисную терапию, в том числе такой гепатотоксичный препарат, как метотрексат - 71 (39%) пациент.
Повышение уровня трансаминаз выше верхней границы нормы отмечалось у 13 (7,2%) детей из 181, включенного в исследование. Из них 7 больных лечились диклофенаком, 3 - нимесулидом, 2 - мелоксикамом. У одной девочки (на основании данных анамнеза) отмечалось развитие гепатотоксичности на фоне лечения различными НПВП (напроксен, диклофенак, нимесулид, мелоксикам). Повышение уровня трансаминаз до значений от одной до двух норм регистрировалось у 8 детей, от двух до трех - у 2 пациентов, от трех и более - в двух случаях. По данным ультразвуковой диагностики, у 8 из 13 детей наблюдалось увеличение размеров печени (+1-1,5 см), у 9 - небольшое повышение эхогенности паренхимы печени, и у 5 - усиление сосудистого рисунка.
Среди больных, лечившихся диклофенаком (n = 100), 41 (41%) мальчик и 59 (59%) девочек. Средняя длительность заболевания составила 4 года; средний возраст детей - 10,6 лет. С диагнозом ЮРА были 62 (62%) ребенка, ЮХА - 25 (25%), ЮСА - 6 (6%), РеА - 5 (5%), ПсА - 2 (2%) пациента. Препарат применялся в стандартной дозировке (2-3 мг/кг массы тела/сут). В исследуемой группе появление признаков гепатотоксичности отмечалось у 7 (7,0%) детей, из них у 4 пациентов с ЮРА, у 2 - с ЮХА, у 1 - с ЮСА. Активность болезни у этих больных соответствовала 1-2 степени. Все дети с признаками лекарственной гепатотоксичности вместе с диклофенаком принимали и другие потенциально токсичные лекарственные препараты: 2 пациента - антибиотики, 2 - метотрексат и сульфасалазин, 1 - преднизолон в сочетании с метотрексатом и гидроксихлорохином. Гепатотоксический эффект наблюдался также и у ребенка, у которого в анамнезе на фоне приема диклофенака было зафиксировано неоднократное повышение уровня трансаминаз при использовании не только НПВП, но и базисных препаратов (лефлуномида, метотрексата, сульфасалазина). На момент начала исследования, в сочетании с диклофенаком он принимал метотрексат и сульфасалазин.
По данным ультразвуковой диагностики, увеличение размеров печени на 1-1,5 см на фоне лечения диклофенаком отмечалось у 5 больных, повышение эхоген-ности паренхимы - у 4, усиление сосудистого рисунка - у 2 пациентов. Повышение уровня трансаминаз на 1-2 нормы регистрировалось у 5 детей, от двух до трех - у 1, от трех и более - в одном случае. В группу больных, принимавших мелоксикам, вошли 54 ребенка - 35 (65%) девочек и 19 (35%) мальчиков. Средняя длительность заболевания была выше, чем в других группах, и составила 6 лет, средний возраст - 13,2 лет. ЮРА был диагностирован у 33 (61%) детей, ЮХА - у 12 (22%), ЮСА - у 8 (15%), РеА - у 1 (0,2%) больного. Средняя доза мелоксикама составила 10,6 мг/сут.
Развитие гепатотоксичности было отмечено у 2 (3,7%) детей: у 1 с суставной формой ЮРА и 3 степенью активности болезни, и у 1 - с системной формой ЮРА и 1 степенью активности болезни.
По данным анамнеза, один больной в связи с тяжестью состояния одновременно с мелоксикамом при-нимал метотрексат и сульфасалазин, второй - метотрексат. Учитывая, что больные получали мелоксикам в комбинации с иммунодепрессантами, в том числе с метотрексатом, гепатотоксичность могла быть связана с одновременным назначением нескольких препаратов, обладающих гепатотоксичным эффектом. По данным ультразвукового обследования, увеличение размеров печени: правой доли на 1,5 см, левой - на 1 см отмечалось у одного ребенка, повышение эхогенности паренхимы и усиление сосудистого рисунка - у двоих. В изучаемой группе повышение уровня трансаминаз у обоих пациентов с признаками гепатотоксичности не превышало двух норм.
В группу больных, принимавших нимесулид, вошло 27 детей - 21 (78%) девочка и 6 (22%) мальчиков, из них 12 (44%) детей - с ЮРА, 12 (44%) - с ЮХА, 3 (11%) - с РеА. Средняя длительность заболевания составила 4,3 года, средний возраст детей - 10,8 лет. Препарат использовался в стандартной дозировке (5 мг/кг массы тела/сут).
В этой группе гепатотоксичность развилась у трех детей (11,1%), из них у 2-х - с ЮРА, у 1 - с ЮХА. У всех детей активность болезни соответствовала 1-2 степени. Один ребенок в комбинации с нимесулидом принимал метотрексат, двое других детей получали монотерапию нимесулидом в дозе 100 мг/сут.
По данным ультразвукового обследования, увеличение размеров печени на 1-1,5 см в группе детей, лечившихся нимесулидом, отмечалось у одного пациента, повышение эхогенности паренхимы - у 2-х детей. У одного больного регистрировалось повышение уровня трансаминаз до значений от одной до двух норм, у другого - от двух до трех, и у третьего уровень трансаминаз превышал значения трех норм (табл. 4).
Таблица 4. Признаки поражения печени на фоне терапии различными НПВП
Характеристики Группа мелоксикама
(n = 54)Группа диклофенака
(n = 100)Группа нимесулида
(n = 27)Больные с гепатотоксичностью, абс. (%) 2 (3,7) 7 (7,0) 3 (11,1) Повышение уровня трансаминаз, абс. от 1 до 2-х норм 0 5 1 от 2-х до 3-х норм 2 1 1 от 3-х норм и более 0 1 1 Поражение печени по данным УЗИ, абс. 2 6 2 увеличение размеров печени 0 5 0 повышение эхогенности 1 4 1 усиление сосудистого рисунка 2 2 2 Статистически значимых различий в частоте возникновения гепатотоксичности в сравниваемых группах выявлено не было (р > 0,05). Однако имелась тенденция к более высокой частоте повышения уровня трансаминаз в группе больных, получавших в качестве НПВП - нимесулид, в то время как в группе пациентов, получавших мелоксикам, частота повышения трансаминаз была самой низкой.
Заключение
Противовоспалительная терапия ювенильных артритов с применением Мовалиса снижает риск развития клинических проявлений НПВП-гастропатий (болевого синдрома, выраженности обложенности языка, пальпаторной болезненности в области эпигастрия), а также эрозивных и язвенных поражений ЖКТ. На фоне комплексной терапии детей с ювенильными артритами, включавшей мелоксикам, было отмечено снижение клинико-лабораторной активности заболевания. На основании результатов мониторирования уровня трансаминаз и данных ультразвукового обследования признаки гепатотоксичности были выявлены у 7,2% детей, что свидетельствует о низкой гепатотоксичности проанализированных НПВП. Однако имелась тенденция к повышению уровня трансаминаз в группе больных, получавших в качестве НПВП нимесулид, в то время как в группе пациентов, получавших мелоксикам, частота повышения уровня трансаминаз была самой низкой. Серьезных клинических проявлений поражения печени не было отмечено ни у одного из больных, лечившихся НПВП.
СПИСОК ЛИТЕРАТУРЫ
1. Жолобова Е. С., Шахбазян И. С., Климанская Е. В. и др. Роль различных факторов в развитии патологии верхних отделов желудочно-кишечного тракта при хронических артритах у детей // Российский педиатрический журнал. 2003. 3. С. 37-40.
2. Муравьёв Ю. В. Гепатотоксичны ли НПВП? // Науч-практич. ревматология. 2002. 4. С. 36-41.
3. Rostom А., Goldkind L., Laine L. Nonsteroidal Anti-Inflammatory Drugs and Hepatic Toxicity: A Systematic Review of Randomized Controlled Trials in Arthritis Patients. // Clinical Gastroenterology and Hepatology. 2005. 3. P 489-498.
4 perto N., Nikishina I., Pachanov E. et al. A Randomized Double-blind clinical trial of two doses of Meloxicam compared with naproxen in children with JRA // Arthr. Rheum. 2005. 52. P. 563-572.
5. Traversa G., Bianchi C., Da Cas R. et al. Cohort study of hepatotoxicity associated with nimesulide and other nonsteroidal anti-inflammatory drugs // ВМJ. 2003. 327. P. 18-22.
6. Walker A. M. Quantitative studies of the risk of serious hepatic injury in persons using nonsteroidal antiinflammatory drugs // Arthritis Rheum. 1997. 40. P. 201-208.
7. Алексеева Е. И., Щербаков П. Л., Бзарова Т. М. и др. Лечение гастропатий с применением ингибиторов протонной помпы рабепразола и эзомепразола у детей с ревматическими заболеваниями. Сборник материалов Х конгресса педиатров России "Актуальные проблемы педиатрии" 2006. 18 с.
8. Никишина И. П., Комелягина Е. Г. Рациональные принципы применения нестероидных противовоспалительных препаратов в педиатрической практике // Педиатрия. Прил. 3. 2003. С. 40-44.
9. Муравьёв Ю. В.,Осипова Е. В.,Алексеева А. В., Дыдыкина И. С. Токсическое повреждение печени диклофенаком натрия // Клин. фармакология и терапия. 2002. 2. С. 94-96.
10. Merlani G., Fox M., Oehen H. P., Cathomas G. et al. Fatal hepatotoxicity secondary to nimesulide // Eur. J. Clin. Pharmacol. 2001. 57. P. 321-326.
| Июль 2010 г. |