Опубликовано в журнале:
«CONSILIUM MEDICUM» »» ТОМ 14 № 8 2012г.
Механизмы формирования моторных функциональных нарушений.
Эффекты селективных М3-холинолитиков у пациентов с гастроэнтерологической патологиейВ.Б.Гриневич, Е.И.Сас, Ю.А.Кравчук, Н.Н.Щербина, А.И.Орос
Военно-медицинская академия им. С.М.Кирова, Санкт-Петербург
В настоящее время внимание большинства гастроэнтерологов мира приковано к изучению функциональных моторных нарушений (ФМН). Причина этого довольно проста: развитие функциональных нарушений предвосхищает формирование основных гастроэнтерологических патологий, является ответной реакцией на стрессорные ситуации, а в случае уже сформировавшейся патологии функциональные нарушения определяют агрессивность течения заболеваний [1, 2]. Диагностика и терапия ФМН может являться эффективной как первичной, так и вторичной профилактикой гастроэнтерологических заболеваний. В этой связи возможность изучения миграционного моторного комплекса (ММК) с помощью высокоразрешающей манометрии открывает большие перспективы как на раннюю диагностику функциональных нарушений, так и на изучение причин, вызывающих их (рис. 1).
Рис. 1. Высокоразрешающая запись манометрии ММК. (E.Deloose и соавт., 2012) The migrating motor complex: control mechanisms and its role in health and disease Nat Rev Gastroenterol Hepatol; doi:10.1038/nrgastro.2012.57.
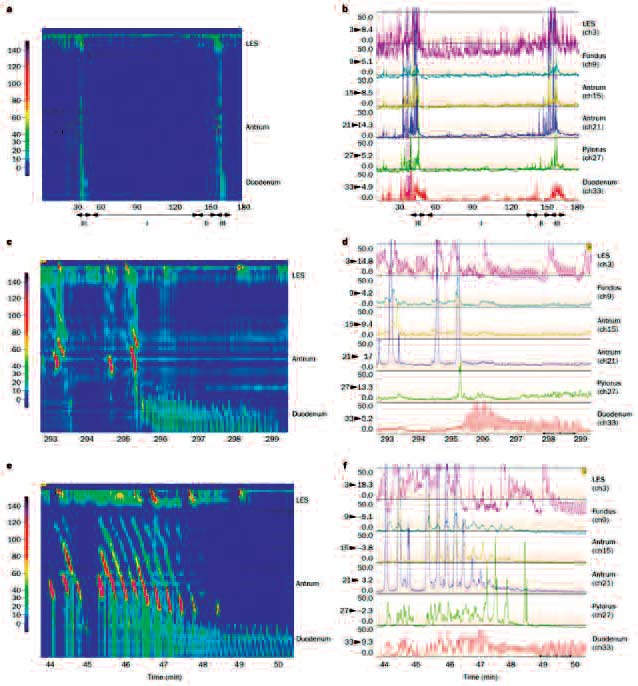
Особое внимание уделяется изучению миграционного моторного комплекса (ММК) в покое, или так называемой базовой активности желудочно-кишечного тракта (ЖКТ). В условиях стимуляции (пробный завтрак либо обычное повседневное питание) на ЖКТ суммарно воздействуют множество систем: центральная (ЦНС) и автономная нервные, эндокринная, APUD-система и т.д., взаимно дублируя друг друга, что закономерно и определяется важностью процесса пищеварения для жизнедеятельности человеческого организма. Таким образом, возникающие сбои в работе той или иной системы, как правило, компенсируются и скрываются на раннем этапе. Изучение ММК в покое позволяет выявлять ранние, предшествующие развитию клинически значимых изменений нарушения, что дает возможность проводить анализ значимости этиологических факторов, способствующих развитию функциональных нарушений. В покое у человека имеется базовая моторная активность, отражающая согласованность действий всех органов ЖКТ.
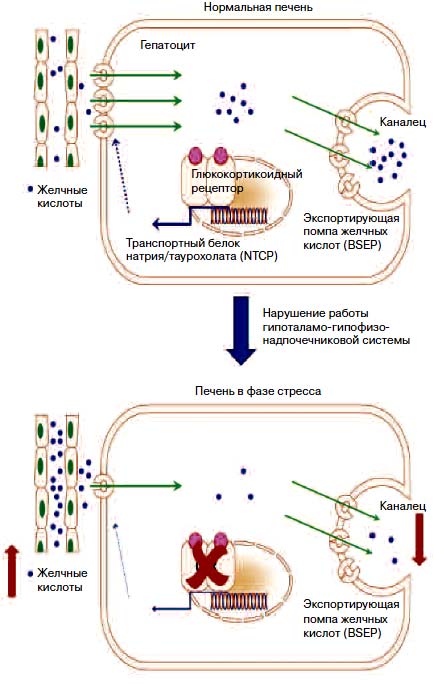
Большое внимание уделяется также III фазе ММК - так называемой стадии возбуждения, предшествующей развитию сокращения (IV фаза). В ходе выполненных мультицентровых исследований E.Deloose и соавт. (2012 г.) было установлено, что на развитие, амплитуду и своевременность развития III фазы влияют определенные факторы, значение которых и ранее рассматривалось в этиологии формирования ФМН (см. таблицу). При этом необходимо отметить вклад разных факторов в развитие нарушений антральной, дуоденальной и кишечной фаз. Было отмечено закономерное взаимное влияние моторных комплексов друг на друга, что также определяет согласованность работы ЖКТ. При этом наибольшее влияние как на антральную, так и на дуоденальную III фазу ММК оказывает микробно-тканевой комплекс кишечника (рис. 2). Влияние, оказываемое им, дублируется автономной вегетативной нервной системой, APUD-системой, а также путем регуляции энтерогепатической циркуляции желчных кислот и поддержанием постоянства рН кишечного содержимого (рис. 2). Так, уровень желчных кислот в тонкой кишке стимулирует активность APUD-системы кишечника. В свою очередь, длительная стрессорная ситуация, приводящая к истощению симпатоадреналовой системы и снижению уровня кортизола, отрицательно влияет на гепатоэнтеральную циркуляцию желчных кислот. В эксперименте на животных было установлено, что в фазе стресса-истощения у мышей резко повышается литогенность желчи посредством влияния на гепатоэнтеральную циркуляцию желчных кислот глюкокортикоидных ядерных рецепторов (рис. 3). Таким образом, на стадии формирования ФМН мы уже наблюдаем воздействие сразу нескольких факторов: действие вегетативной нервной системы, стрессорные воздействия (через ЦНС и метаболическими путями), которые реализуются впоследствии изменением реологии желчи, и гормональная активность жировой ткани (в случае избыточной массы тела либо паратрофий).
Рис. 2. Механизмы, участвующие в регуляции ММК. (E.Deloose и соавт., 2012). The migrating motor complex: control mechanisms and its role in health and disease. Nat Rev Gastroenterol Hepatol; doi:10.1038/nrgastro.2012.57.

Рис. 3. Связь гепатоэнтеральной циркуляции желчных кислот с уровнем кортизола, взаимодействующего с ядерным глюкокортикоидным рецептором (на рис. 2 мыши в фазе стресса - истощения с дефицитом кортизола и снижением обратной абсорбции и секреции желчных кислот).
Следующий механизм, который необходимо рассмотреть, - изменение кишечного рН. Как видно из предложенной E.Deloose схемы, закисление кишечного содержимого опосредованно через APUD-системы кишечника приводит к развитию спазма в верхних этажах ЖКТ. Реакция являет защитный характер с целью предупреждения дальнейшего закисления кишечной среды. Однако она требует также своего разрешения: включения в комплексную терапию секретолитического средства.
Отдельного внимания заслуживает рассмотрение проблемы избыточной массы тела, связь которой уже доказана как с функциональными нарушениями, так и с развитием впоследствии онкологических заболеваний ЖКТ. В этой связи вопрос эффективного лечения ФМН переходит из плоскости нивелирования кинетических расстройств к решению задачи по комплексной терапии моторных и метаболических нарушений, часть из которых инициируется гормонально активной жировой тканью (см. таблицу). Неотъемлемым звеном в терапии ФМН ЖКТ является использование спазмолитических препаратов с целью разрешения возникающих гиперкинетических расстройств. Препаратом выбора в данном случае следует рассматривать гиосцина бутилбромид (Бускопан®). Обладая селективным М3-холинолитическим эффектом, гиосцина бутилбромид при приеме внутрь связывается с мускариновыми рецепторами, расположенными на висцеральных гладких мышцах ЖКТ, препятствуя взаимодействию с ними медиатора ацетилхолина. Таким образом, работая на первом этапе развития спазма (активация М-холинорецепторов мышечного волокна), Бускопан® вызывает быстрое спазмолитическое действие, которое и обусловливает скорое наступление клинического эффекта, и это приводит к быстрому разрыву патологического круга: ЦНС - повышение двигательной и секреторной активности ЖКТ - спазм - болевая афферентация - ЦНС. Препарат не оказывает прямого анальгетического воздействия, что принципиально важно при параллельном проведении дифференциального поиска. Низкое всасывание из ЖКТ предопределяет отсутствие побочных нейротропных и системных антихолинергических эффектов (даже в дозах, превышающих лечебную: 600 мг) [13, 14]. В то же время наличие секретолитического эффекта позволяет ему влиять на секретиновый и гастриновый механизмы регуляции функциональной активности ЖКТ. Не менее важной является способность гиосцина бутилбромида опосредованно через М3-холинорецепторы регулировать секрецию инсулина, оказывая положительное метаболическое воздействие, нашедшее в последние годы дополнительные подтверждения [5, 6]. Кроме того было установлено, что блокада М3-холино-рецепторов у мышей может защитить от метаболических нарушений, связанных с развитием разных видов экспериментально индуцированного ожирения. Во всех проводимых исследованиях блокада М3-рецепторов значительно уменьшает нарушения гомеостаза глюкозы и чувствительность к инсулину у экспериментальных животных на фоне развития ожирения. D.Gautam было высказано предположение о том, что М3-рецепторы могут представлять собой потенциальную мишень для фармакологического лечения ожирения и связанного с последним нарушения обмена веществ [8].
Таблица 1. Действие гастроинтестинальных гормонов, нейромедиаторов и некоторых лекарственных средств на ММК
(по данным E.Deloose и соавт., 2012. The migrating motor complex: control mechanisms and its role in health and disease.
Nat Rev Gastroenterol Hepatol; doi:10.1038/nrgastro.2012.57.
Мотилин Индуцирует III фазу ММК гастритического происхождения Атропин Ингибирует III фазу ММК гастритического происхождения Грелин Индуцирует III фазу ММК гастритического происхождения Соматостатин Ингибирует III фазу ММК гастритического и дуоденального происхождения Панкреатический полипептид Ремодулирует III фазу ММК дуоденального происхождения на глоточную Инсулин Не исследовался у людей Серотонин Управление и ремодуляция с изменением скорости и миграции III фазы ММК Холецистокинин Стимуляция моторной активности, нарушение ММК тонкой кишки Макролиды В низких дозах (40 мг) индуцирует III фазу ММК гастритического происхождения, в высоких (200 мг)
- индуцирует дуоденальную III фазу ММКПароксетин, цитопролам Ремодулирует III фазу ММК интестинального происхождения, ремодулирует II фазу
ММК интестинального и глоточного происхожденияКсенин Ингибирует III фазу ММК дуоденального происхождения Также было сделано предположение, что селективная блокада М3-холинорецепторов имеет двойной механизм: с одной стороны, воздействие непосредственно на автономную нервную систему, с другой -посредством влияния на М3-рецепторы гладкомышечных клеток сосудов и регуляции кровоснабжения островков Лангерганса. Результаты исследований М3-холинорецепторов на макрофагах позволили в настоящее время рассмотреть возможные механизмы модуляции системной воспалительной реакции, что имеет принципиальное значение как регуляция развивающейся в ответ на цитокиновую агрессию инсулинорезистентности [14, 15]. Крайне важно в этой связи формирование F.Suneng и соавт. так называемого метаболического круга в ответ на стрессовую реакцию: находящиеся в верхней части нарушения нейроэндокринного характера при сопутствующих нарушениях микробиоты (формирующих системную воспалительную реакцию) и диетических нарушениях приводят как к митохондриальной дисфункции (энергетика клетки), так и к «стрессу эндоплазматического ретикулума» (дезорганизация синтетической функции клетки). Таким образом, мы можем совершенно по-другому посмотреть на формирование функциональных моторных расстройств с вовлечением субклеточных механизмов, а значит, искать новые подходы к терапии данной патологии, основанные на нивелировании моторных и метаболических нарушений с вовлечением базовых физиологических механизмов.
Рис. 4. Метаболический круг формирования функциональных расстройств на фоне стресса. F.Suneng, M.Steven, Watkins, S.Gökhan. Cell Metabolism, Volume 15, Issue 5, 623–634.

ВЫВОД. Рассмотрение механизмов формирования функциональных моторных расстройств привело нас к заключению о многоуровневом вовлечении в процесс метаболических, гормональных неврогенных нарушений, которые обусловливают не только резинтентность к терапии, но и проградиентность течения заболевания. Подходы к терапии должны включать препараты со спазмолитической, секретолитической активностью, положительно влияющие на метаболический и гормональный балансы и микробно-тканевой комплекс кишечника. Сочетание в себе сразу нескольких эффектов (спазмолитический, секретолитический и метаболический) позволяет рассматривать селективный М3-холинолитик гиосцина бутилбромид как перспективный препарат в терапии ФМН.
Список использованной литературы
- Flegal KM, Carroll MD, Ogden CL, Curtin LR. Prevalence and trends in obesity among US adults 1999-2008JAMA 2010; 303: 235-41.
- Wilson PW, D'Agostino RB, Sullivan L. Overweight and obesity as determinants of cardiovascular risk: the Framingham experience. Arch Intern Med 2002; 162:1867-72.
- Ogden CL, Yanovski SZ, Carroll MD, Flegal KM. The epidemiology of obesity. Gastroenterology 2007; 132:2087-102.
- van Geenen EJ et al. Nonalcoholic fatty liver disease is related to nonalcoholic fatty pancreas disease. Pancreas 2010; 39: 1185-90.
- Jindal RD, Keshavan MS. Critical role of M3 muscarinic receptor in insulin secretion. Implications for psychopharmacology. J Clin Psychopharmacol 2007; 26 (5): 449-50.
- Gilon P, Henquin JC. Mechanisms and physiological significance of the cholinergic control to pancreatic beta-cell function. Endocr Rev 2011; 22 (5): 565-604.
- Smits M M, van Geenen EJM. The clinical significance of pancreatic steatosis. Nat Rev Gastroenterol Hepatol 2011; 8:169-77.
- Dinesh Gautam Molecular Signaling Section, Laboratory of Bioorganic Chemistry, National Institute of Diabetes and Digestive and Kidney Diseases, Bethesda, Maryland Mouse Metabolic Core Laboratory, National Maryland Institute of Diabetes and Digestive and Kidney Diseases, Bethesda.
- Tytgat GN. Hyoscine butylbromide - a review on its parenteral use in acute abdominal spasm and as an aid in abdominal diagnostic and therapeutic procedures. Curr Med Res Opin 2008.
- Renuka TR, Robinson R, Paulose CS. Increased insulin secretion by muscarinic M1 and M3 receptor function from rat pancreatic islets in vitro. Neurochem Res 2006; 31: 313-20. [PMID:16733808].
- Renuka TR, Savitha B, Paulose CS. Muscarinic M1 and M3 receptor binding alterations in pancreas during pancreatic regeneration of young rats. Endocrine research 2005;31 (4): 259-70.
- Renuka TR; Das V Ani, Paulose CS. Alterations in the muscarinic M1 and M3 receptor gene expression in the brain stem during pancreatic regeneration and insulin secretion in weanling rats. Life sciences 2004; 75 (19): 2269-80.
- Rodriguez-DiazR, Abdulreda MH, Formoso AL. New research redraws pancreas anatomy Autonomic axons in the human endocrine pancreas show unique innervation patterns.
- Гриневич ВБ, Сас ЕИ., ФАКарев и др. Метаболические эффекты селективного М-холинолитика (гиосцина бутилбромида) у больных с хроническим панкреатитом. Гастроэнтерология Санкт-Петербурга. 2010; 10:2-7
- Гриневич ВБ., Ласый ВП, Сас ЕИ. и др. Метаболический синдром у больных с заболеваниями органов пищеварения: значение для теории и практики. Рос. кардиол. журн. М., 2003; 1: 74-80.
| Январь 2013 г. |