Опубликовано в журнале:
W. Birkmayer. Современные проблемы и ведение болезни Паркинсона (материалы симпозиума, Базель, апрель 1984), изд-во “Рош”, 1985 г.Периферическое ингибирование декарбоксилазы: биохимическое сравнение бенсеразида и карбидопы
M. Da Prada
Обнаружение сильного снижения концентрации дофамина (ДА) в базальных ганглиях пациентов с болезнью Паркинсона привело к разработке заместительной терапии препаратами леводопы (L-3,4-дигидроксифенилаланина). Недостатком монотерапии препаратами ДОФА (диоксифенилаланина) были такие побочные эффекты, как тошнота, рвота и ортостатическая гипотония, вызванные образованием дофамина на периферии. Сочетание ДОФА и ингибитора декарбоксилазы, действующего только на периферии, позволило резко уменьшить выраженность этих побочных эффектов (2, 6, 8, 22, 24). Можно предположить, что выраженное подавление активности периферической декарбоксилазы снижает количество ДА, образующегося на периферии, и увеличивает количество дофамина, попадающего в головной мозг (3, 5, 18, 19).
Комбинация леводопы с ингибитором дофа-декарбоксилазы (ИДД) выпускается в виде препарата «Мадопар». Мадопар содержит леводопу в сочетании с периферическим ИДД бенсеразидом в соотношении 4:1, а комбинации леводопы с периферическим ИДД карбидопой выпускаются сейчас в соотношении 4:1, а также 10:1. На рисунке 1 показана структурная формула бенсеразида [N1-(DL-серил)-N2(2,3,4-тригидроксибензил)гидразина гидрохлорида] и карбидопы (L-a-гидразино-a-метил-b-(3,4-дигидроксифенил)пропионовой кислоты . Н2О].
В данном исследовании впервые проведено сравнение подавляющего эффекта бенсеразида и карбидопы на дофа-декарбоксилазу в печени, почках и головном мозге крыс. Вторым показателем степени ингибирования фермента на периферии была концентрация эндогенного дофамина в плазме крыс после назначения им бенсеразида или карбидопы. Наконец, у здоровых добровольцев определяли плазменные концентрации ДОФА, 3-О-метилдопы и неконъюгированного ДА после перорального приема Мадопара-125 (4:1) в капсулах или карбидопы-леводопы 1:4 (в таблетках).
Цель данного исследования заключалась в том, чтобы с помощью вышеупомянутых биохимических параметров установить, имеет ли одна из комбинаций преимущество перед другой в лечении болезни Паркинсона.
Рисунок 1.
Структурные формулы бенсеразида (Ro-4-4602) и карбидопы (MK 486, справа).

Подавление декарбоксилазы после приема бенсеразида или карбидопы
Одновременное назначение ДОФА и ингибитора периферической декарбоксилазы способствует образованию ДА из ДОФА в головном мозгу и блокирует этот процесс на периферии. Это и является целью назначения ингибитора дофа-декарбоксилазы, активного только на периферии. Нижеследующие эксперименты на крысах были предназначены для того, чтобы установить, в какой степени бенсеразид или карбидопа могут предотвратить декарбоксилирование ДОФА на периферии.
Периферическое и центральное ингибирование декарбоксилазы после перорального назначения бенсеразида или карбидопы крысам
На рисунках 2 и 3 показана степень подавления активности декарбоксилазы через 4 часа после назначения различных доз бенсеразида или карбидопы в печени, почках и головном мозге крыс.
Рисунок 2.
Подавление дофа-декарбоксилазы в головном мозге, почках и печени крыс через 4 часа после перорального приема различных доз бенсеразида. Активность фермента определяли с применением в качестве субстрата 14С-допы в концентрации 10-3 моль/л в присутствии пиридоксальфосфата в концентрации 10-5 моль/л (14). Каждую дозу вводили четырем крысам; определение активности фермента проводили троекратно. Показатели представлены в виде средних и стандартной ошибки среднего.
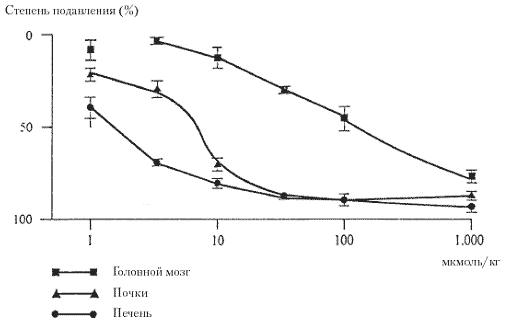
Рисунок 3.
Подавление активности дофа-декарбоксилазы в головном мозге, печени и почках крыс через 4 часа после перорального приема различных доз карбидопы (описание процедуры см. в подписи к рисунку 2).

Как видно из рисунка 2, выраженного (на 70-80%) подавления активности декарбоксилазы в печени и почках можно достичь через 4 часа после перорального назначения бенсеразида в дозе 10 мкмоль (2.9 мг), при этом степень подавления активности этого фермента в головном мозге довольно слабая (около 10%). Максимальное подавление декарбоксилирования в печени и почках (около 90%) отмечается уже при назначении бенсеразида в дозе 30 мкмоль (8.8 мг) на кг массы тела. При назначении этой дозы отмечалось лишь небольшое подавление центральной активности (около 25%). У пациентов с болезнью Паркинсона можно ожидать даже менее выраженного подавления центральной активности декарбоксилазы, поскольку терапевтическая доза ингибитора фермента составляет лишь 2 – 5 мкмоль/кг. По крайней мере, у крыс для выраженного подавления активности декарбоксилазы в ЦНС необходимо 1000 мкмоль бенсеразида на кг массы тела. Явно другие результаты получаются при назначении карбидопы, как показано на рисунке 3. Карбидопа даже в дозе 100 мкмоль (24.4 мг) на кг не подавляет активность декарбоксилазы в печени и почках крыс через 4 часа после приема более, чем на 40-50%, а повышение дозы в 3 – 10 раз (до 300 – 1000 мкмоль/кг) не приводит к более выраженному подавлению активности фермента в печени. В почках в такой ситуации активность фермента подавляется на 60-80%, а в головном мозге – на 20-40%.
В заключение следует отметить, что через 4 часа после перорального приема бенсеразида в ограниченном диапазоне доз достигается выраженное угнетение периферической активности фермента, в то время как карбидопа оказывает лишь слабый ингибирующий эффект на изученные периферические органы.
Эти данные подтверждают ранее полученные результаты (3, 4), которые продемонстрировали, что передозировка высокоактивного ингибитора декарбоксилазы бенсеразида может также привести к подавлению активности декарбоксилазы в головном мозге крыс. В отличие от этого, карбидопа, в связи с более низкой активностью, подавляет активность фермента в головном мозге и печени крыс, самое большее, на 50%, а в почках – на 80%. Более выраженное подавление центральной декарбоксилазы, которое отмечается при назначении эквимолярных доз бенсеразида, вероятно, обусловлено, значительно более высокой мощностью бенсеразида, а не более высокой степенью его проникновения через гематоэнцефалический барьер.
Динамика подавления активности декарбоксилазы у крыс после приема бенсеразида или карбидопы
Подавление активности дофа-декарбоксилазы в периферических органах направлено на достижение «ДОФА-сберегающего» эффекта на протяжении периода времени, целесообразного с терапевтической точки зрения. В частности, оно нацелено на поддержание как можно меньшей частоты и степени тяжести побочных эффектов, вызванных образующимся на периферии ДА, и на достижение максимального попадания ДОФА в ЦНС (4).
Рисунки 4 и 5 четко показывают, в какой степени бенсеразид и карбидопа удовлетворяют этим требованиям. Поскольку ни одна доза карбидопы не позволяла добиться полного подавления дофа-декарбоксилазы в периферических органах (рисунок 3), то кривые динамики подавления строились с указанием дозы, которая давала максимальное подавление хотя бы в одном из двух изученных периферических органов при сравнительно незначительном влиянии на головной мозг. На рисунке 4 показано подавление дофа-декарбоксилазы через различные промежутки времени после назначения бенсеразида в дозе 30 мкмоль (8.8 мг) на кг, а на рисунке 5 – после назначения карбидопы в дозе 300 мкмоль (73.2 мг) на кг.
Рисунок 4.
Подавление активности дофа-декарбоксилазы в головном мозге, печени и почках крыс после перорального приема бенсеразида в дозе 30 мкмоль (8.8 мг) на кг массы тела (описание процедуры см. в подписи к рисунку 2).

Рисунок 5.
Подавление активности дофа-декарбоксилазы в головном мозге, печени и почках крыс после перорального приема карбидопы в дозе 300 мкмоль (73.2 мг) на кг массы тела (описание процедуры см. в подписи к рисунку 2).

В этих дозах оба ингибитора практически не меняют активность дофа-декарбоксилазы в головном мозге (не более 20% ингибирования). Однако, бенсеразид в дозе 30 моль на кг через 1-4 часа после назначения обеспечивает выраженное подавление активности фермента в печени и почках (рисунок 4), в то время как в мозгу такой эффект не достигается даже при назначении карбидопы в дозе 300 мкмоль/кг (рисунок 5). После назначения большой дозы карбидопы – 300 мкмоль/кг – степень подавления активности фермента в печени не превышает 50%. Через 8 – 16 часов после назначения бенсеразида в дозе 30 мкмоль/кг активность декарбоксилазы в печени и почках остается сниженной в большей степени, чем после назначения карбидопы в дозе 300 мкмоль/кг. Сравнение двух кривых показывает, что у крыс бенсеразид превосходит карбидопу по ингибирующей мощности и по селективности (в терапевтическом диапазоне доз подавление активности фермента только на периферии).
Концентрации ДОФА в плазме крыс после перорального назначения бенсеразида или карбидопы
Измерение концентраций эндогенного ДОФА в плазме стало возможным после разработки высокочувствительного радиоэнзиматического метода (25). Типичные показатели лежат на уровне 0.54± 0.06 нг (2.7 пмоль) дофы в 1 мл плазмы, а медиана концентрации у человека равняется 1.4± 0.09 нг (7.1 пмоль) ДОФА в 1 мл плазмы.
У крыс концентрации ДОФА в плазме определяли через различные промежутки времени после назначения эквимолярных доз бенсеразида или карбидопы (5.1 мкмоль на кг). Как показано на рисунке 6, плазменные концентрации эндогенного ДОФА после приема бенсеразида заметно и стойко повышаются (через 2 часа после приема концентрации ДОФА возрастают в 18 раз). В тех же условиях карбидопа демонстрирует сравнительно небольшой и транзиторный эффект, причем концентрации ДОФА повышаются лишь примерно в 4 раза.
Рисунок 6.
Плазменные концентрации свободного эндогенного ДОФА и норадреналина у крыс (n = 8) после перорального назначения 5.1 мкмоль бенсеразида или карбидопы. Уровни дофы и норадреналина определяли радиоэнзиматическим методом. Представлены средние и стандартные ошибки средних (*р < 0.01 для сравнения бенсеразида и карбидопы, t-тест Стьюдента).

Плазменные концентрации свободных неконъюгированных катехоламинов (на рисунке 6 показаны только концентрации норадреналина) также определялись радиоэнзиматическим методом (12) и практически не менялись в описанных выше условиях эксперимента.
У человека бенсеразид (5.1 мкмоль/кг внутрь) вызывал резко выраженное повышение концентрации эндогенного ДОФА в плазме (через 2-3 часа после приема – примерно на 900%), в то время как карбидопа в эквимолярной дозе оказывала лишь незначительный эффект (через 3-4 часа после приема – на 300%) (10).
Определение плазменных концентраций эндогенного ДОФА у крыс и у человека дало практически одинаковые результаты, свидетельствуя о том, что у человека бенсеразид заметно превосходит карбидопу как ингибитор периферической декарбоксилазы. Показанное ранее in vitro подавление активности катехол-О-метилтрансферазы под действием бенсеразида, вероятно, не играет роли в эффектах этого вещества у человека, поскольку эксперименты на крысах продемонстрировали небольшое подавление активности катехол-О-метилтрансферазы in vivo только после назначения доз, значительно превышавших дозы, необходимые для подавления декарбоксилазы (1).
Концентрации ДОФА в плазме человека после назначения «Лародопы» (леводопы) или «Мадопара»
На рисунке 7 показаны концентрации ДОФА в плазме после приема Лародопы (леводопы) в дозе 200 мг и после приема Мадопара 250. Через 1 – 10 часов после приема Мадопар 250 повышает уровни ДОФА в плазме примерно в 5 – 10 раз сильнее, чем Лародопа в дозе 200 мг. Этот мощный эффект обусловлен подавлением периферической декарбоксилазы (в желудочно-кишечном тракте, печени, почках и т.д.), связанным с улучшением биодоступности ДОФА. Как видно из почти параллельных кривых на рисунке 7, период полувыведения ДОФА при приеме Мадопара или Лародопы не изменяется. Эти данные подтверждают ранее полученные результаты, указывающие на то, что при назначении ДОФА в виде монотерапии или в комбинации с бенсеразидом период его полувыведения составляет 45-60 минут (13, 21).
Рисунок 7.
Концентрации ДОФА в плазме у здоровых добровольцев после перорального приема Мадопара 250 или Лародопы 200 мг. Время между приемом двух препаратов составило 3 дня. Уровни ДОФА определяли радиоэнзиматическим методом.

Плазменные концентрации ДОФА, 3-О-метилдоппы и дофамина у человека после приема Мадопара 125 или карбидопы-леводопы
Плазменные концентрации ДОФА и 3-О-метилдопы определяли одновременно с помощью ВЭЖХ (высокоэффективная жидкостная хроматография с электрохимической детекцией) (15). Концентрацию дофамина в плазме определяли отдельно с помощью радиоэнзиматического метода (12). Концентрация эндогенной 3-О-метилдопы в плазме человека достигает примерно 104 пмоль (22 нг) в 1 мл. Это почти в 15 раз выше, чем концентрация ДОФА (7пмоль в 1 мл).
Уровни дофамина в плазме составляют около 10-50 пг в 1 мл, но на него приходится лишь около 0.5% суммарного дофамина, поскольку большая часть дофамина в плазме присутствует в виде сульфатов (9, 23). После перорального приема Мадопара 125 (100 мг ДОФА, 25 мг бенсеразида) или карбидопы-леводопы (100 мг леводопы, 25 мг карбидопы) здоровыми добровольцами уровни ДОФА и 3-О-метилдопы в плазе определяли через разные промежутки времени.
Как показано на рисунках 8 и 9, кривые динамики концентраций после приема Мадопара и карбидопы-леводопы сходные. Концентрация ДОФА достигает максимума через 30-50 минут после приема (около 800 нг ДОФА в 1 мл плазмы) и падает в пределах 2 часов примерно до одной четвертой от максимального значения (около 200 нг ДОФА в 1 мл плазмы).
Рисунок 8.
Концентрации ДОФА и 3-О-метилдопы в плазме у 6 здоровых добровольцев после приема 1 капсулы Мадопара 125. Уровни ДОФА и 3-О-метилдопы определяли с помощью ВЭЖХ. Стандартная ошибка среднего (на рисунке не показана) была менее 20%).

Рисунок 9.
Концентрации ДОФА и 3-О-метилдопы в плазе у 6 здоровых добровольцев после перорального приема 1 таблетки карбидопы-леводопы (описание процедуры см. на рисунке 8).

В отличие от выраженного первоначального повышения концентрации ДОФА в плазме, уровень 3-О-метилдопы достигает плато медленнее и остается повышенным дольше (около 10 часов).
Далее, следует отметить, что максимальные значения 3-О-метилдопы отмечаются через 1.5 часа после приема Мадопара 125, но не ранее 3 часов после приема карбидопы-леводопы. Это может объясняться неполным периферическим подавлением активности декарбоксилазы при приеме карбидопы-леводопы. Если это предположение верно, то после приема карбидопы-леводопы в плазме должны обнаруживаться более высокие концентрации дофамина (свободного или конъюгированного). Для изучения этого вопроса у некоторых обследуемых определяли концентрации свободного дофамина в плазме радиоэнзиматическим методом, и данное предположение подтвердилось: через час после приема карбидопы-леводопы уровни дофамина в плазме превышали стандартные показатели более, чем в 100 раз. В отличие от этого, после приема Мадопара 125 они были лишь в 3-4 раза выше исходных (рисунок 10). Этот результат вновь позволяет предполагать, что периферическое ингибирование декарбоксилазы после приема Мадопара 125 более выражено, чем после приема карбидопы-леводопы.
Рисунок 10.
Концентрации свободного дофамина у 5 здоровых лиц после приема Мадопара 125 или карбидопы-леводопы. Оба препарата содержат 100 мг леводопы и 25 мг периферического ингибитора декарбоксилазы – бенсеразида или карбидопы. Интервал времени между приемом двух препаратов составил 7 дней. Уровень дофамина определяли радиоэнзиматическим методом. Стандартные ошибки средних (на рисунке не показаны) были менее 20%.

Другие эксперименты, не представленные в данной публикации, показали, что предварительный прием бенсеразида в течение 6 дней заметно не влиял на повышение уровня дофамина в плазме, вызванное приемом Мадопара.
С другой стороны, параллельные исследования с 6-дневным периодом предварительного приема карбидопы в эквимолярной дозе показали выраженное повышение концентрации дофамина в плазме. Это можно расценивать как то, что бенсеразид подавляет периферическую декарбоксилазу сильнее, чем карбидопа, даже в условиях субхронического приема. В плане лечения болезни Паркинсона это может означать, что периферические побочные эффекты будут чаще возникать при приеме карбидопы-леводопы, чем при приеме Мадопара.
У человека периферическое ингибирование декарбоксилирование ДОФА изучали и после внутривенного введения бенсеразида или карбидопы в сочетании с ДОФА. Измеряя уровни свободного дофамина, дигидроксифенилуксусной кислоты и гомованилиновой кислоты в плазме, удалось показать, что после приема бенсеразида подавление периферической декарбоксилазы более выражено, чем после приема карбидопы (23).
В заключение следует отметить, что биодоступность ДОФА после приема Мадопара 125 не отличается от таковой после приема карбидопы-леводопы (1%4). О более выраженном подавлении активности декарбоксилазы свидетельствовали два факта: во-первых, более быстрое повышение концентрации 3-О-метилдопы в плазме после Мадопара 125 и, во-вторых, кратковременное, но выраженное повышение концентрации свободного дофамина в плазме после приема карбидопы-леводопы (1:4).
Заключение
Настоящие результаты показали, что бенсеразид представляет собой периферический ингибитор декарбоксилазы, мощность которого в 10 раз выше мощности карбидопы. Мадопар 125 или карбидопа-леводопа не влияют на биодоступность ДОФА в плазме. Из-за более слабого подавления периферической декарбоксилазы под влиянием карбидопы отмечалось существенное возрастание концентраций дофамина в плазме после приема карбидопы-леводовы (1:4), позволяющее предположить более высокую частоту побочных эффектов (тошноты, рвоты, ортостатической гипотонии).
Чтобы компенсировать умеренное подавление декарбоксилазы на периферии, концентраций карбидопы в препарате карбидопы-леводопы была существенно увеличена (1:4). Несмотря не это, уровни дофамина в плазме у здоровых добровольцев указывают, что периферическое ингибирование декарбоксилазы под влиянием карбидопы-леводопы выражено слабее, чем то, которое отмечается под влиянием Мадопара 125 (2).
Лечение паркинсонизма можно оптимизировать (избежать частого приема препаратов, уменьшить частоту дискинезий и эффекта «включения-выключения») посредством формы выпуска с контролируемым высвобождением активного вещества. Можно ожидать, что при лечении такой формой выпуска концентрация ДОФА в плазме будет возрастать довольно умеренно, на протяжении нескольких часов, достигая плато, вместо первоначального резкого подъема. Подобная форма с контролируемым высвобождением была разработана для Мадопара 125 (Мадопар ГСС). Проводятся клинические исследования, которые покажут, обладает ли Мадопар 125 ГСС ожидаемыми преимуществами.
Библиография
1. BALDESSARINI, R. J., GREIXER, E.: Inhibition of Catechol_O_methyl Trans_ ferase by Catechols and Polyphenols. Biochem Pharmacol 22, 247_256 (1973).
2. BARBEAU, A., ROY, M.: Six_year Results of Treatment with Levodopa plus Benserazide in Parkinson's Disease. Neurology (Minneap) 26, 399_404 (1976).
3. BARTHOLINI, G., PLETSCHER, A.: Effect of Various Decarboxylase Inhibitors on the Cerebral Metabolism of Dihydroxyphenylalanine. J Pharm Phar macol 21, 323_324(1969).
4. BARTHOLIN'I, G., PLETSCHER, A.: Decarboxylase Inhibitors. Pharmacol TherBl, 407_421 (1975).
5. BIANCHINE, J.R., SHAW, G.M.: Clinical Pharmacokinetics of Levodopa in Parkinson's Disease. Clin Pharmacokinet I, 313_338 (1976).
6. BIRKMAYER, W., DANIELCZYK, W., RIEDERER, P.: Symptoms and Side Effects in the Course of Parkinson's Disease. J N enrol Trans fSnppl] 19, 185_199 (1983).
7. Buu, N.T., KUCHEL, O., PARENT, M.T.: Competitive Inhibition of Cate chol_O_methyl Transferase by Ro 4_4602.Can J Biochem 55, 771_773 0977).
8. CALNE, D.B., REID, J.L., VAKIL, S.D., SUMANT RAO. PETRIE, A., PALLIS, C.A., GAWLER, J., THOMAS, P.K.,HILSON, A.: Idiopathic Parkinsonism Treated with an Extracerebral Decarboxylase Inhibitor in Combination withLevodopa. Br Med J 1971/3, 729_732.
9. DA PRADA, M.: Concentration, Dynamics and Functional Meaning of Cat_ echolamines in Plasma and Urine.Trends Pharmacol Sci 1, 157_159 (1980).
10. DA PRADA, M., KELLER, H.H., PIERI, L., KETTLER, R., HAEFELY, W.E.: Antiparkinson Therapy:Pharmacological Bases and Advances. Experientia (in press).
11. DA PRADA, M., KETTLER, R., HAEFELY, W.E.: Effect of Benserazide and Carbidopa on the Concentration ofEndogenous Dopa in Human and Rat Plasma. Arch Pharmacol 307, R61 (1979).
12. DA PRADA, M., ZURCHER, G.: Simultaneous Radioenzymatic Determina tion of Plasma and Tissue Adrenaline,Noradrenaline and Dopamine Within the Femtomole Range. Life Sci 19, 1161_1174 (1976).
13. DOLLER, H.J., CONNOR, J.D., LOCK, D.R., SLOVITER, R.S., DVORCHIK, B. H., VESELL, E. S.: LevodopaPharmacokinetics: Alterations After Benserazide, a Decarboxylase Inhibitor. Drug Metab Dispos 6, 164_168 (1978).
14. DREYFUS, P.M., HAUSER, G.: A Single Micromethod for the Collection of Radioactive Carbon Dioxide inDecarboxylation Experiments. Mikrochim Ichnoanal Acta 1, 150_151 (1964).
15. GUNDERT_REMY, U., HINDEBRANDT, R., STIEHL, A., WEBER, E., ZURCHER, G., DA PRADA, M.: IntestinalAbsorption of Levodopa in Man. Eur J Clin Pharmacol25, 69_72 (1983).
16. HOHN, M.M.: Increased Dosage of Carbidopa in Patients with Parkinson's Disease Receiving Low Doses ofLevodopa. Arch Neurol 37, 146_149 (1980).
17. KURUMA, I., BARTHOLINI, G., TISSOT, R., FLEISCHER, A.: Comparative Investigation of Inhibitors ofExtracerebral Dopa Decarboxylase in Man and Rats. J Pharm Pharmacol 24, 289_294 (1972).
18. FINDER, R.M., BROGDEN, R.N., SAWYER, P.R., SPEIGHT, T.M., AVERY, E.S.: Levodopa and DecarboxylaseInhibitors _a Review of Their Clinical Pharmacology and Use in the Treatment of Parkinsonism. Drugs 11, 329_377(1976).
19. FLEISCHER, A.: Effect of Inhibitors of Extracerebral Decarboxylase on Levodopa Metabolism. Adv Neurol 3, 49_58(1973).
20. RINNE, U. K., MOLSA. P.: Levodopa with Benserazide or Carbidopa in Par kinson's Disease. Neurology 29, 1584_1589 (1979).
21. RINNE, U.K., SONNINEN, V., SiiRTOLA, Т.: Treatment of Parkinsonian Patients with Levodopa and ExtracerebralDecarboxylase Inhibitor, Ro 4_4602. Adv Neurol3, 59_71 (1973).
22. RINNE, U.K., SONNINEN, V., SIIRTOLA, Т.: Plasma Concentration of Levo dopa in Patients with Parkinson'sDisease. Eur Neurol 10, 301_310 (1973)
23 THER, E., et al.: In Preparation.
24. WANG, P._C, Buu, N.T., KUCHEL, O., GENEST, J.: Conjugation Patterns of Endogenous Plasma Catecholamines inHuman and Rat. A New Specific Method for Analysis of Glucuronide_conjugated Catecholamines. J Lab Clin Med101, 141_151 (1983).
25. YAHR, M.D.: Overview of Present Day Treatment of Parkinson's Disease. J Neural Transm 43, 227_238 (1978).
26. ZURCHER, G., DA PRADA, M.: Radioenzymatic Assay of Femtomole Con centrations of Dopa in Tissues and BodyFluids. J Neurochem 33, 631_639 (1979).
| Январь 2006 г. |