Опубликовано в журнале:
CONSILIUM-MEDICUM »» Том 06/N 9/2004 Синдром поликистозных яичников
Международный диагностический консенсус (2003 г.) и современная идеология терапии
Д.Е.Шилин
Российская медицинская академия последипломного образования МЗ и СР РФ, МоскваВведение
В 2005 г. исполнится 70 лет с момента первой зарубежной публикации о патологии, которая впоследствии получила название синдрома Штейна–Левенталя, по фамилиям авторов – чикагских гинекологов [1]. За это время эпонимическое обозначение синдрома сменилось на клинико-патогенетическое – синдром поликистозных яичников (СПКЯ), а представление медиков об этом эндокринном заболевании (Е28.2 по МКБ-10) трансформировалось из разряда редкой патологии в категорию чрезвычайно распространенной и поэтому – социально-значимой. Так, к концу ХХ века в крупных независимых исследованиях, выполненных в разных странах, получены достаточно однородные эпидемиологические сведения, указывающие на широкую распространенность СПКЯ среди женщин фертильного возраста – порядка 5% (3–10%) в популяции. Более того, на смену ранее бытовавшему клиническому пониманию данного состояния как частой патологии исключительно репродуктивного плана к началу третьего тысячелетия пришло новое осмысление СПКЯ как глобальной проблемы соматического здоровья – эндокринно-метаболического статуса, сердечно-сосудистого и онкологического риска.
Вместе с тем за столь длительное время резко обозначились существенные различия в клиническом, диагностическом и классификационном толковании СПКЯ среди представителей разных специальностей, научных течений и школ, географических частей света. По этой причине и подходы к лечению одной и той же пациентки, предпринимавшиеся на приемах разных врачей, могли принципиально отличаться, а это делало невозможным достигать высокой результативности назначаемой терапии, правильно оценивать и точно сравнивать ее истинную эффективность. Единственная (до недавнего времени) согласованная попытка сближения точек зрения на диагностику СПКЯ была предпринята в 1990 г. на Международной конференции US NIH (Национального института здоровья; г. Бетесда, США) [2]. На основании, скорее, практического опыта экспертов, чем на доказательной базе контролируемых клинических испытаний, которые в то время не пользовались особой популярностью, были утверждены следующие диагностические критерии: клинические или биохимические признаки гиперандрогении, хроническая ановуляция и исключение других известных нарушений (табл. 1).
С той поры минуло почти 15 лет, и благодаря новым достижениям в изучении патогенеза СПКЯ и совершенствованию диагностических технологий стало очевидным, что назрела крайняя необходимость жесткой ревизии дефиниции синдрома, критериев постановки данного диагноза, а также уточнения роли и места выявления инсулинорезистентности в практике обследования каждой пациентки с проявлениями гиперандрогении и менструальной дисфункции [5]. Самым значимым и неоспоримым фактом, послужившим основой для неизбежного пересмотра диагностических критериев, стало общее признание того, что синдром реально включает в себя намного более широкий спектр жалоб, симптомов и лабораторно-инструментальных признаков овариальной дисфункции, чем казалось раньше [6].
Консенсус о критериях диагноза СПКЯ (пересмотр 2003 г.)
Назревшая проблема была вынесена на рассмотрение специального Международного симпозиума объединенной рабочей группы ESHRE/ASRM (Европейского общества репродукции и эмбриологии человека и Американского общества репродуктивной медицины) [3]. Симпозиум состоялся 1–3 мая 2003 г. в Роттердаме (Нидерланды) под председательством B.Tarlatzis (Греция) и B.Fauser (Нидерланды). В нем приняли участие 27 ведущих экспертов Научный комитет: Chang (США), Azziz (США), Legro (США), Dewailly (Франция), Franks (Великобритания), Tarlatzis (Греция), Fauser (Нидерланды). Участники дискуссии: Balen (Великобритания), Bouchard (Франция), Dahlgren (Швеция), Devoto (Чили), Diamanti (Греция), Dunaif (США), Filicori (Италия), Homburg (Израиль), Ibanez (Испания), Laven (Нидерланды), Magoffin (США), Nestler (США), Norman (Австралия), Pasquali (Италия), Pugeat (Франция), Strauss (США), Tan (Канада), Taylor (США), Wild (США), Wild (Великобритания). из 12 стран с четырех континентов планеты.
Как и ранее, в заключительном документе Роттердамского консенсуса было закреплено положение, что СПКЯ остается диагнозом, требующим исключения других известных нарушений, которые проявляются универсальными клиническими признаками гиперандрогении, а поэтому могут имитировать и протекать “под маской” СПКЯ (см. далее). В то время как сам СПКЯ представляет собой синдром овариальной дисфункции (нерегулярные месячные, стойкая ановуляция, бесплодие), к специфическим проявлениям которой относятся не только гиперандрогения, но и “поликистозная” морфология яичников (см. табл. 1). Тем самым впервые была достигнута договоренность о необходимости придания ультразвуковой оценке размеров и структуры ткани яичников статуса равноправного диагностического критерия.
Согласно консенсусу наличие хотя бы двух из трех утвержденных критериев позволяет после исключения иных состояний верифицировать диагноз СПКЯ. Таким образом, с одной стороны, в плане обследования СПКЯ остается синдромом (комплексом симптомов), идентификация которого невозможна и недопустима на основании изолированного наличия любого единственного диагностического критерия (одиночно от остальных двух). С другой стороны, простой анализ попарного сочетания современных критериев позволяет сделать принципиальный вывод о необходимости расширенного толкования термина СПКЯ. Это связано с дополнительным включением в его дефиницию новых клинических форм, а именно: в отсутствие другой гиперандрогенной патологии диагноз СПКЯ допустимо выставлять не только при классическим течении (полной триаде признаков), но и при наличии одного из трех неполных (неклассических) клинико-инструментальных дуэтов. К ним отнесены:
1) сочетание гиперандрогении с морфологическими признаками овариального поликистоза, но на фоне регулярных по ритму менструаций и ановуляторных по незрелости фолликулов (т.е. на фоне “ановуляторных циклов”. – Прим. авт.);
2) сочетание менструальной дисфункции с ультразвуковыми (УЗ) – признаками овариального поликистоза, но в отсутствие гиперандрогении (в отечественной литературе – так называемая безгирсутная форма СПКЯ. – Прим. авт.);
3) сочетание менструальной дисфункции с гиперандрогенией, но в отсутствие явной УЗ-картины овариального поликистоза.
По нашему мнению, подобная констатация такого выраженного клинического полиморфизма СПКЯ вполне объяснима. Он отражает не столько реальное многообразие и частоту нетипичных (неполных, стертых) “портретов” патологии, сколько его клиническую эволюцию (стадийность) у пациенток разного возраста и национальности с различной генетической предрасположенностью и фенотипической индивидуальностью. Объединение названных четырех форм патологии в общий синдром на этапе постановки диагноза позволяет чаще применять современные терапевтические технологии: причем не только на этапе лечения, но и для профилактики СПКЯ; у все более широкого круга пациенток, в том числе у самых молодых, даже на стадии полового созревания.
Диагностические критерии для клинических испытаний и семейных исследований
Предполагается, что названные критерии диагностики для клинической практики, возможно, не будут столь пригодными для клинических испытаний, направленных на оценку исходов СПКЯ. Поэтому при планировании клинической апробации фармакологических препаратов для медикаментозной индукции овуляции, средств для коррекции гирсутизма или метаболических нарушений рекомендуется на этапе включения в исследование придерживаться принципа стратификации (формирования групп испытаний) по ведущему признаку, идентифицирующему СПКЯ, – соответственно, по наличию ановуляции, степени патологического роста терминальных волос или инсулинорезистентности.
Изучение семейно наследуемых случаев СПКЯ важно для понимания широкого фенотипического спектра столь гетерогенной патологии, а также для выявления генов предрасположенности к ней. В подобных исследованиях будет оправданно более узкое толкование диагноза для выявления пораженных членов семей – по изолированному наличию только овариального поликистоза или гиперандрогенемии как таковой.
Исключение сходных состояний
Перечень заболеваний, протекающих с клинической симптоматикой, напоминающей СПКЯ и по этой причине требующих исключения для постановки данного диагноза, представлен в табл. 2. Хотя круг перечисленных состояний достаточно большой, их суммарный вклад в структуру случаев гиперандрогенной ановуляции по распространенности существенно уступает СПКЯ. Тем не менее этиологическое своеобразие этих заболеваний требует дифференцированной патогенетической терапии, во многом отличающейся от таковой при СПКЯ.
В связи с этим участники симпозиума при разработке консенсуса пришли к согласованному решению о необходимости рутинного (обязательного) исследования ряда гормональных параметров, по нормальным концентрациям которых в сыворотке крови у пациентки с 2–3 клиническими критериями, подозрительными на наличие СПКЯ, можно исключить иные варианты патологии и окончательно идентифицировать СПКЯ как таковой (см. табл. 2). В их число включены 17-гидроксипрогестерон, тиреотропный гормон, пролактин, кортизол. Кроме того, крайне важной представляется особая клиническая настороженность во избежание опасности диагностической ошибки, связанной с пропуском достаточно редких, но наиболее грозных и потенциально фатальных болезней надпочечников или яичников (гиперкортицизм, вирилизирующая опухоль).
Гиперандрогения
С практической точки зрения наиболее простым и надежным способом установления гиперандрогении является клиническое выявление ее признаков путем полуколичественной (балльной) оценки гирсутизма (патологического оволосения в андрогензависимых участках лица, туловища и конечностей по шкале Ферримэна и Голлвея) с учетом наличия простых угрей (acne vulgaris) и/или облысения по мужскому типу (андрогенной алопеции). В этих случаях лабораторная верификация избытка андрогенов в крови (моче) не нужна.
В редких случаях для идентификации “безгирсутной” формы СПКЯ оправданно дополнительное гормональное исследование, направленное на установление повышенного содержания мужских половых гормонов в сыворотке крови (бессимптомной гиперандрогенемии). Уточняется, что в подобной ситуации наиболее информативным служит расчетный метод оценки индекса свободного тестостерона как результата деления стократной величины уровня общего тестостерона на уровень глобулина, связывающего половые гормоны (ТЭСГ). Особо подчеркивается, что при гиперандрогенных состояниях прямое определение содержания свободного тестостерона, как и определение концентрации общего тестостерона и андростендиона, в современной практике не рекомендуется (по лабораторно-техническим или патофизиологическим причинам).
Измерение уровня дегидроэпиандростерона-сульфата если и упоминается, то в редких случаях, и предлагается лишь для идентификации асимптоматической гиперандрогенемии, но только не для дифференциальной диагностики (!) СПКЯ с первично-надпочечниковой патологией (адреногенитальным синдромом).
Изучение ренальной экскреции мочевых метаболитов андрогенов (суммарных 17-кетостероидов и их фракций) вообще не обсуждается, на наш взгляд, ввиду их крайне низкой информативности и неудовлетворительной воспроизводимости.
Лютеинизирующий гормон
Две трети пациенток с СПКЯ имеют абсолютное повышение содержания лютеинизирующего гормона (ЛГ) в циркуляции за счет избыточной амплитуды и/или учащения выбросов этого гормона в системный кровоток, и до 95% пациенток – относительное повышение ЛГ в сравнении с нормально низким уровнем фолликулостимулирующего гормона (ФСГ), судя по так называемому гонадотропному индексу (ЛГ/ФСГ>2). Оценка данного маркера-индикатора предлагается в качестве необязательного вторичного критерия в диагностически неясных случаях, особенно у худых пациенток с аменореей, а также с исследовательской целью в научных проектах.
Поликистозные яичники
Авторы консенсуса 2003 г. в отличие от разработчиков предыдущего документа четко заявили, что морфологическая (сонографическая) верификация овариального поликистоза должна приниматься во внимание в качестве одного из возможных критериев диагноза СПКЯ. Но интерпретация данного критерия возможна только в совокупности с клинической оценкой репродуктивного статуса пациентки (менструально-овуляторной дисфункции яичников) и/или клинических (реже – лабораторных) признаков гиперандрогении. По этой причине окончательное заключение о СПКЯ может формулироваться только клиницистом, тогда как УЗ-описание подозрительной морфологии без учета анамнестических и клинико-лабораторных данных не дает права для постановки данного диагноза и тем более для назначения любого лечебного вмешательства.
Наряду с кратким упоминанием специфических эхо-признаков в тексте основного консенсуса [3] дополнительно было подготовлено и опубликовано детализированное руководство для специалистов УЗ-диагностики [4]. Его основные положения суммированы в табл. 3. Для клиницистов, оценивающих эти инструментальные признаки, крайне важно назначать УЗ-исследование малого таза на 3–5-й день менструального цикла (синхронно с гормональным обследованием), а также понимать главное требование, предъявляемое к его протоколу, обязательное измерение в максимальном сечении всех трех линейных размеров каждого яичника. Только эти результаты позволяют по простой формуле максимально точно устанавливать реальное увеличение их объема [7]. И наоборот, чем меньшее количество размеров органа представлено в протоколе УЗ-исследования, тем более трудоемкой становится технология расчета объема, либо резко падает точность результата (табл. 4).
Инсулинорезистентность
Снижение чувствительности периферических тканей к инсулину в среднем на 50% выявляется при СПКЯ как минимум в 2–3 раза чаще, чем в общей популяции. Причем этот феномен носит универсальный характер и присущ данной патологии независимо от наличия и степени выраженности ожирения – как тучным, так и худым пациенткам любого возраста. Возраст и величина избытка массы тела определяют только распространенность и интенсивность инсулинорезистентности на уровне печени, жировой и мышечной ткани. Рефрактерность к инсулину этих клеток влечет за собой компенсаторное увеличение продукции гормона поджелудочной железой – гиперинсулинемию, которая запускает массу неблагоприятных дисметаболических нарушений (со стороны углеводного и липидного обмена). Но чувствительность к инсулину в андрогенпродуцирующих структурах яичников и надпочечников при этом не страдает, а в ответ на гиперинсулинизм выработка мужских половых гормонов только возрастает, что усугубляет клинику гиперандрогении.
Заслугой консенсуса 2003 г. в отличие от предыдущей версии является то, что впервые заявляется как патофизиологическая, так и клиническая роль инсулинорезистентности (см. далее). Но с учетом известных сложностей в лабораторной идентификации этого состояния по прямым параметрам продукции инсулина на современном этапе практическая диагностика нарушений углеводного обмена рекомендуется только при наличии дополнительных факторов метаболического риска – пациенткам с СПКЯ, имеющим ожирение и/или отягощенную наследственность по сахарному диабету типа 2 [3]. Поскольку к моменту выработки консенсуса по СПКЯ экспертная группа гинекологов-эндокринологов располагала рекомендациями диабетологов по диагностике метаболического синдрома, разработанными до этого в 1997–2001 гг. [8–10], было предложено всем остальным пациенткам данные исследования пока не проводить.
Вместе с тем следует отметить, что состоявшийся всего лишь через полгода после симпозиума в Роттердаме Первый Всемирный конгресс по инсулинорезистентности (21–22 ноября 2003 г.; Лос-Анджелес, США) рассмотрел рекомендации Американской ассоциации клинических эндокринологов [11, 12], согласно которым при СПКЯ независимо от других факторов клинико-анамнестического риска и без проведения гормонального анализа инсулинорезистентность может быть установлена по наличию хотя бы 2 из 4 суррогатных признаков – по повышению уровня триглицеридов, снижению уровня холестерина липопротеидов высокой плотности артериальной гипертензии, гипергликемии натощак или через 2 ч после углеводной нагрузки (табл. 5).
Резюме
Подводя черту под обзором вновь представленных в консенсусе 2003 г. критериев СПКЯ, можно констатировать, что за счет внедрения в алгоритм обследования пациенток с гиперандрогенным бесплодием метода УЗ-исследования малого таза и изъятия из этого арсенала ряда неинформативных гормональных параметров, в целом диагностика СПКЯ стала более доступной, менее инвазивной, более дешевой и более точной. Настолько точной, насколько это необходимо для грамотного выбора современной рациональной тактики лечения.
Современная идеология терапии СПКЯ
Индивидуальная тактика ведения конкретной пациентки с СПКЯ нередко зависит не только от установленного нозологического варианта патологии, но и от текущей жизненной ситуации в семье, где проводится планирование беременности. С учетом этого терапию СПКЯ условно можно разделить на 2 группы: базовую – когда длительно исполняется комплексная реабилитационная программа и планомерная подготовка молодой женщины к беременности, и ситуационную – когда по желанию пациентки неотложно решается вопрос о восстановлении фертильности.
Базовая терапия
Арсенал помощи пациенткам с СПКЯ представлен ныне большой фармакотерапевтической группой мощных лекарственных средств, оказывающих специфические и принципиально отличные воздействия на разные патогенетические звенья (рис. 1). Индивидуальный комплекс мероприятий разрабатывается с учетом наличия или отсутствия указаний на инсулинорезистентность, образа пищевого поведения и вредных привычек. Базовая терапия предусматривает два основных сценария лечения: а) для худых без гиперинсулинизма – антиандрогенные (рис. 2) ± эстроген-гестагенные препараты; б) для имеющих избыточную массу тела – сенситайзеры инсулина в сочетании с мероприятиями по нормализации массы тела.
Наиболее ощутимым и значимым следствием открытия роли инсулинорезистентности в формировании СПКЯ стала новая терапевтическая технология с применением лекарственных препаратов, повышающих чувствительность инсулиновых рецепторов. Следует сразу оговориться, что группа метформина и глитазонов показана хотя и абсолютному большинству пациенток, но не всем. Совершенно очевидно, что для отбора на терапию инсулинсенсибилизирующими препаратами явное преимущество имеют только лица, удовлетворяющие критериям периферической рефрактерности к гормону.
С момента публикации в 1994 г. статьи коллектива авторов из Венесуэлы и США Velazquez EM, Mendoza S, Hamer T, Sosa F, Glueck CJ. Metformin therapy in polycystic ovary syndrome reduces hyperinsulinemia, insulin resistance, hyperandrogenemia, and systolic blood pressure, while facilitating normal menses and pregnancy. Metabolism. 1994; 43 (5): 647–54. о первом опыте применения метформина при СПКЯ прошло 10 лет. За эти годы опубликовано еще около двухсот работ по данному вопросу. В большинстве из них представлены сведения об испытаниях нерандомизированных, неконтролируемых и, как правило, малочисленных по включенным в опытные выборки пациенткам. Такой уровень научного анализа не удовлетворяет современным жестким требованиям доказательной медицины. Поэтому исключительный интерес представляют публикации систематизированных аналитических обзоров и итоги метаанализа по сводным данным из сопоставимых по дизайну испытаний [13–15]. Подобные работы появились лишь в течение последнего года, и их обсуждение важно как для текущей практики, так и на перспективу. В табл. 6 приводим сводные данные наиболее очевидных и систематически воспроизводимых эффектов метформина при СПКЯ.
Таблица 1.
Диагностические критерии СПКЯ и сходных состояний
Состояния и критерии их диагностики СПКЯ
Критерии Первой Международной конференции US NIH
(Национального института здоровья США; 1990 г.) [2]при наличии обоих следующих критериев:
- Менструальные нарушения и ановуляция
- Клинические и/или биохимические признаки гиперандрогении
при отсутствии других причин (гиперпролактинемии, тиреоидной патологии, поздней формы адреногенитального синдрома, синдрома гиперкортицизма)
Критерии по консенсусу Симпозиума рабочей группы ESHRE/ASRM
(Европейского общества репродукции и эмбриологии человека и Американского общества репродуктивной медицины; 2003 г.) [3]при наличии любых двух критериев из трех следующих:
- Менструальная дисфункция с ановуляцией
- Клинические и/или биохимические признаки гиперандрогенемии
- Наличие поликистозных яичников по данным УЗ-исследования [2]
Поликистозные яичники (по данным УЗ-исследования [4])
Идиопатический гирсутизм
- Эхографические признаки поликистоза яичников в отсутствие менструальной дисфункции, клинических и биохимических признаков гиперандрогении
- Избыточное оволосение в андрогензависимых зонах лица, тела, конечностей в отсутствие менструальной дисфункции и гиперандрогенемии
Таблица 2.
Дифференциальный диагноз СПКЯ от других причин гиперандрогении [2, 3]
СПКЯ– это диагноз исключения других эндокринопатий
Гиперандрогенные состояния
Главные “маркеры”
1. Идиопатический гирсутизм
Rt + “мужской анамнез” а
2. Неклассический вариант ВДКН
17-оксипрогестерон б
3. Гиперпролактинемический гипогонадизм
ПРЛ
4. Первичный гипотиреоз
ТТГ
5. Вирилизирующие опухоли
Клиника в + “объем” Н/Я г
6. Тотальный гиперкортицизм
Клиника д + кортизол
Примечание.
а – родственники-мужчины с ранним началом облысения (андрогенной алопеции) и/или с семейным типом избыточного оволосения по мужской линии;
б – дискриминационный порог выше 2–3 мкг/л (6,9–10,4 нМоль/л);
в – вирилизация наружных половых органов и гортани (клиторомегалия, ларингомегалия, барифония);
г – при визуализации надпочечников и яичников;
д – “кушингоидизация” внешности с перераспределением жира по верхнему типу + стероидные стрии, плетора, геморрагии, остеопороз.Таблица 3.
Ультразвуковая семиотика поликистозных яичников (ПКЯ): дефиниции Международного консенсуса [4]
Дефиниции
1. ПКЯ должны иметь хотя бы один из следующих признаков: либо 12 фолликулов и более, имеющих диаметр 2–9 мм, либо увеличение овариального объема (>10 см3). При наличии доминантного фолликула (>10 мм) или желтого тела УЗ-исследование необходимо повторить во время следующего менструального цикла.
2. Субъективное впечатление о ПКЯ не должно заменять настоящую дефиницию. Нельзя пропускать описание распределения фолликулов, так же как повышения эхогенности стромы и/или объема. Хотя последнее специфично для ПКЯ, было показано, что в клинической практике измерение овариального объема является хорошим заменителем количественной оценки стромы.
3. Только тот яичник, который удовлетворяет настоящему определению или отвечает хотя бы одному из перечисленных выше критериев, определяется как ПКЯ. При наличии доминантного фолликула (>10 мм) или желтого тела УЗ-исследование необходимо повторить во время следующего менструального цикла. Наличие патологической кисты или асимметрии яичников, которое может указывать на гомогенную кисту, требует дальнейшего обследования.
4. Настоящее определение неприменимо к женщинам, принимающим пероральные контрацептивные препараты в связи с тем, что размер яичников уменьшается даже при возможном сохранении “поликистозного” вида.
5. Женщина, имеющая ПКЯ в отсутствие нарушения овуляции или гиперандрогении (бессимптомные ПКЯ), не должна рассматриваться как имеющая СПКЯ до дальнейшего выяснения ситуации.
6. Наряду с особой ролью в диагностике ПКЯ, УЗ-исследование полезно для прогнозирования окончательной фертильности у пациенток с СПКЯ (ответная реакция на прием кломифена цитрата, риск синдрома гиперстимуляции яичников, принятие решения о зрелости яйцеклеток in vitro). Признается, что появление ПКЯ в отсутствие явных признаков СПКЯ возможно у женщин, подвергающихся стимуляции яичников для оплодотворения в пробирке. УЗ-исследование позволяет также проводить скрининг гиперплазии эндометрия.
7. Необходимо соблюдать следующие технические рекомендации:
- Требуется высококлассное оборудование, которое должно управляться адекватно обученным персоналом
- При возможности необходимо отдавать предпочтение трансвагинальному доступу, особенно у тучных пациенток
- Регулярно менструирующие женщины должны обследоваться в раннюю фолликулярную фазу (3–5-й день цикла), а женщины с опсо-/аменореей – в случайный день или на 3–5-й день после начала прогестаген-индуцированного кровотечения
- При наличии доминантного фолликула (>10 мм) или желтого тела УЗ-исследование необходимо повторить во время следующего менструального цикла
- Расчет овариального объема проводится с использованием упрощенной формулы для вытянутого эллипсоида (0,5 * длина * ширина * толщина)
- Подсчет фолликулов должен проводиться как в продольном, поперечном, так и в переднезаднем сечениях яичников. Размер фолликулов должен выражаться как средний диаметр, измеренный в трех срезах
Примечание. Применимость трехмерной эхографии, допплерографии и магнитно-резонансной томографии для определения ПКЯ до настоящего времени в достаточной мере не установлена и должна ограничиваться научными исследованиями.
Таблица 4.
Корреляция величин овариального объема, рассчитанного по 14 формулам, с данными трехмерной эхографии [7]
Формулы
Коэффициенты корреляции
π/6 * (д)3
0,10
π/6 * т * (д)2
0,30
π/6 * ш * (д)2
0,49
π/6 * [(т + д)/2]3
0,49
π/6 * (т)2 * д
0,51
π/6 * (ш)3
0,55
π/6 * (т)3
0,61
π/6 * (ш)2 * д
0,61
π/6 * [(ш + д)/2]3
0,61
π/6 * (ш)2 * т
0,67
π/6 * ш * т * д
0,70
π/6 * [(ш + т)/2]3
0,72
π/6 * ш * (т)2
0,73
π/6 * [(ш + т + д)/3])3
0,73
Примечание. p/6=3,142/6І0,524; ш – ширина (поперечный размер), т – толщина (переднезадний размер), д – длина (продольный размер).
Таблица 5.
Современные дефиниции инсулинорезистентности [8–12]
Всемирная организация здравоохранения: метаболический синдром (1999 г.)
Диабет, нарушенная гликемия натощак, нарушенная толерантность к глюкозе или инсулинорезистентность по HOMA и >/=2 из следующих критериев:
EGIR: синдром инсулинорезистентности (1999 г.)
- Окружность талии/окружность бедер >0,90 у мужчин, >0,85 см у женщин
- Триглицериды сывороки >/=150 мг% (1,74 ммоль/л) или холестерин липопротеидов высокой плотности <35 мг% (0,9 мM/л) у мужчин, <39 мг% (1 мM/л) у женщин
- Скорость альбуминурии >20 мкг/мин
- Артериальное давление >/=140/90 мм рт. ст.
Гиперинсулинемия натощак (выше 75 перцентили нормы) и >/= 2 из следующих критериев:ATP III: метаболический синдром (2001 г.) Наличие >/=3 из следующих критериев:
- Гликемия натощак >/=6,1 мM/л, но диабета нет
- Артериальное давление >/=140/90 мм рт. ст. или лечение по поводу гипертензии
- Триглицериды >172 мг% (2 мM/л) или холестерин липопротеидов высокой плотности <40 мг% (1 мM/л) или лечение по поводу дислипидемии
- Окружность талии >/=94 см у мужчин и >/=80 см у женщин
Американский колледж эндокринологии/Американская ассоциация клинических эндокринологов:
- Окружность талии >102 см у мужчин и >88 см у женщин
- Триглицериды сыворотки >/=150 мг% (1,74 ммоль/л)
- Холестерин липопротеидов высокой плотности <40 мг% (1 ммоль/л) у мужчин, <50 мг% (1,3 ммоль/л) у женщин
- Артериальное давление >/=130/85 мм рт. ст.
- Глюкоза в сыворотке крови >/=6,1 мM/л
Синдром инсулинорезистентности (2003 г.) Наличие >/=1 из следующих факторов:
и >/=2 из следующих критериев:
- Наличие кардиоваскулярного заболевания, артериальной гипертензии, СПКЯ, неалкогольного жирового гепатоза или черного акантоза
- В семейном анамнезе наличие сахарного диабета типа 2, артериальной гипертензии или кардиоваскулярной патологии
- В анамнезе наличие гестационного диабета или интолерантности к глюкозе
- Небелая раса
- Малоподвижный образ жизни
- Индекс массы тела >25 кг/м2 и/или окружность талии >100 см у мужчин, >87,5 см у женщин
- Возраст >40 лет
- Триглицериды >150 мг% (1,74 ммоль/л)
- Холестерин липопротеидов высокой плотности <40 мг% (1 ммоль/л) у мужчин, <50 мг% (1,3 ммоль/л) у женщин
- Артериальное давление >/=130/85 мм рт. ст.
- Гипергликемия натощак 6,1–6,9 мM/л или через 120 мин после нагрузки глюкозой 7,8–11,1 мM/л (диабет исключен)
Примечание. ATP III – Adult Treatment Panel, third report – Экспертная панель по обнаружению, оценке и лечению гиперхолестеринемии у взрослых (третий отчет);
EGIR – European Group for the Study of Insulin Resistance – Европейская группа по исследованию инсулинорезистентности;
HOMA – homeostasis model assessment – модель оценки гомеостаза.Таблица 6. Клинико-лабораторные параметры эффективности терапии СПКЯ метформином в течение 6–24 мес (сводные данные систематических обзоров [13–15])
Клинические эффекты
1. Улучшение менструальной функции, индукция спонтанной и
Лабораторные эффектыстимулированной овуляции, повышение частоты зачатия (рис. 3)
2. Снижение частоты спонтанных выкидышей, снижение частоты гестационного диабета, улучшение исходов беременности в отсутствие тератогенного эффекта
3. Уменьшение гирсутизма, угревых элементов, жирной себореи, других симптомов гиперандрогении
4. Снижение аппетита, массы тела, артериального давления
1. Снижение уровня инсулина, инсулиноподобного фактора роста 1-го типа (ИФР-1)
2. Снижение уровня холестерина, триглицеридов, липопротеидов низкой и очень низкой плотности, повышение концентрации липопротеидов высокой плотности
3. Снижение уровня андрогенов, ЛГ, ингибитора активатора плазминогена
4. Повышение уровня тестостерон-эстрадиолсвязывающего глобулина, связывающего белка для ИФР-1Рис. 1. Компоненты базовой консервативной тактики ведения пациенток с СПКЯ.
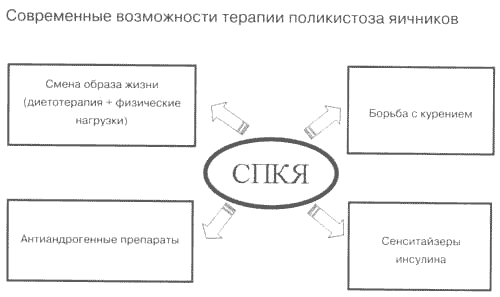
Рис. 2.
Антиандрогенная терапия в лечении СПКЯ с сохранной чувствительностью к инсулину.

Рис. 3.
Репродуктивные эффекты метформина (%) при лечении СПКЯ на фоне инсулинорезистентности.
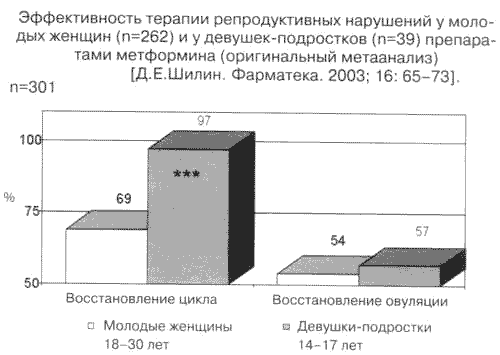
Рис. 4.
Номограмма для оценки прогноза живорождения после индукции овуляции кломифеном цитратом.
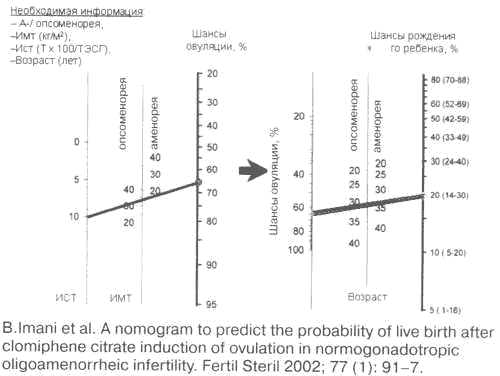
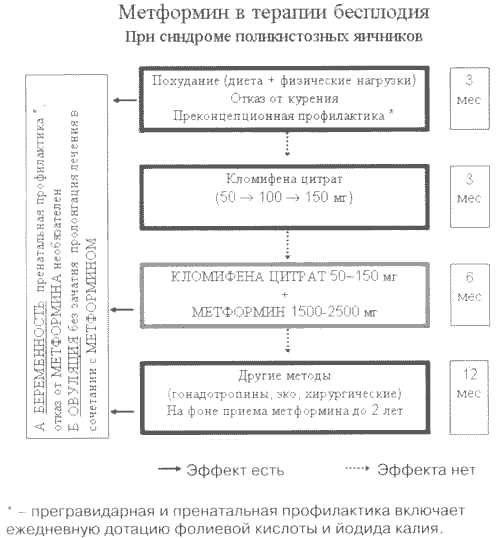
Рис. 5. Лечебно-профилактический план мероприятий по поводу ановуляторного бесплодия при СПКЯ (эупролактинемическом варианте) с включением сенситайзера инсулина (метформина).
В группе сенситайзеров инсулина российским врачам наиболее знаком препарат метформин в дозе 500 и 850 мг. Он стал привычным не только для эндокринологов (при терапии сахарного диабета типа 2), но и для гинекологов-эндокринологов – именно с этого препарата началась история лечения СПКЯ сенситайзерами в нашей стране (М.Б.Анциферов и соавт., 2001; Е.А.Карпова, 2002; Н.Г.Мишиева и соавт., 2001; Г.Е.Чернуха и соавт., 2001).
Режим дозирования. 1-я неделя: 1 таблетка на ночь,
2-я неделя: + 1 таблетка перед завтраком, 3-я неделя: + 1 таблетка перед обедом. Средняя суточная доза 1,5–2,5 г.
Длительность приема. Минимум 6 мес, максимум до 24 мес, средняя продолжительность 1 год.
Перерыв/отмена в приеме препарата осуществляется в течение нескольких дней при любом остром заболевании и проведении рентгеноконтрастных исследований по поводу других состояний (риск лактат-ацидоза).
Ситуационная терапия
В случае первичного консультирования замужней пациентки в бездетном браке многолетняя программа реабилитации чаще всего представляется нереальной. Вопросы лечения бесплодия по своей социальной остроте и неотложности в такой семье не дают времени для достижения базовых эффектов.
В подобной ситуации не исчерпали свою актуальность индукторы овуляции из группы антиэстрогенов (кломифена цитрат, КЦ). В связи с этим привлекает внимание результат многолетних разработок B.Imani и соавт. (2002 г.), которым удалось на основании выяснения предикторов успешности приема КЦ (возраст женщины, характер менструального цикла, индекс массы тела, ИМТ, индекс свободного тестостерона) передать в здравоохранение технически простую номограмму, позволяющую прогнозировать шансы достижения овуляции и даже завершения индуцированной беременности живорождением (рис. 4). Вместе с тем именно при СПКЯ установлена достаточно ощутимая частота случаев, резистентных к КЦ (по разным источникам, в 15–60%).
По этой причине широкой пропаганды заслуживает возможность сенситайзеров (метформина) приводить к установлению не только регулярного, но и часто овуляторного цикла к концу первого полугодия терапии. Этот факт четко доказан в рамках 13 завершенных плацебо-контролируемых рандомизированных проектов, в том числе двойных слепых и перекрестных, в совокупной популяции более 500 женщин с СПКЯ.
Монотерапия метформином по индукции овуляции превышает эффект плацебо вдвое (46% против 24%, p<0,00004), а комбинация его с КЦ позволяет повысить чувствительность к индукторам овуляции у пациенток, ранее резистентных к КЦ, в 5 раз (64% против 12%, p<0,000001). После коррекции на эффект плацебо истинная активность метформина в отношении способности регулировать зачатие оказалась ощутимо высокой только при комбинации с КЦ (52% у КЦ-рефрактерных против 22% при монотерапии у ранее не принимавших КЦ, p<0,000001). На основании этого нами разработан план действий по лечению бесплодия КЦ и метформином на фоне параллельной неспецифической профилактики внутриутробных аномалий развития (рис. 5).
Заключение
Завершая представление новейших сведений по клиническим аспектам диагностики и терапии наиболее распространенных гиперандрогенных состояний, следует еще раз подчеркнуть медико-социальную значимость проблемы СПКЯ как с точки зрения его высокой частоты в женской популяции Земли, так и с позиции общего демографического процесса на планете (снижение рождаемости наряду с ростом соматической заболеваемости, ведущей к снижению продолжительности жизни и ее качества). Вместе с тем достигнутый к началу XXI века очевидный прогресс в стандартизации технологии выявления СПКЯ и появление новых патогенетических схем терапии позволят не только реально улучшить результативность лечения уже сформировавшихся репродуктивных проявлений заболевания, но и своевременно внедриться в эффективную профилактику его мультисистемных и достаточно тяжелых дисметаболических последствий и осложнений. Залогом успешного претворения такой оптимистической перспективы в жизнь может быть только оперативное и повсеместное внедрение рекомендаций Роттердамского соглашения в практическое здравоохранение.
Формин (метформин) -
Июль 2005 г.