Опубликовано в журнале:
CONSILIUM-MEDICUM »» Том 2/N 5/2000 Сахарный диабет типа 2 (патогенез и лечение)
И.Ю. Демидова, И.В. Глинкина, А.Н. Перфилова
Кафедра эндокринологии (зав. - акад. РАМН, проф. И.И. Дедов) ММА им. И.М. СеченоваСахарный диабет (СД) типа 2 был и остается важнейшей медико-социальной проблемой нашего времени, что обусловлено его широкой распространенностью, а также преждевременной инвалидизацией и смертью больных, страдающих данным заболеванием.
Хорошо известно, что преждевременная инвалидизация и смертность больных СД типа 2 в первую очередь связана с его макроваскулярными осложнениями, а именно с теми или иными проявлениями атеросклероза (ИБС, острый инфаркт миокарда, инсульт, гангрена нижних конечностей и пр.).
Многочисленные исследования выявили прямую зависимость между степенью компенсации углеводного обмена, сроками возникновения и темпами прогрессирования макро- и микроваскулярных осложнений СД типа 2. В связи с этим достижение компенсации углеводного обмена является важнейшим звеном в комплексе мероприятий, направленных на предотвращение развития или замедление темпов прогрессирования поздних осложнений данного заболевания.
СД типа 2 - гетерогенное заболевание. Обязательным условием его успешной терапии является воздействие на все известные звенья патогенеза данного заболевания.
Патогенез
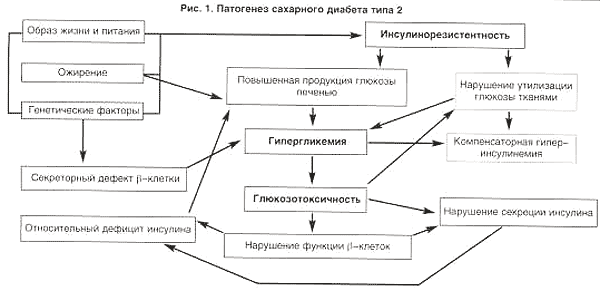
В настоящее время ключевыми звеньями патогенеза СД типа 2 считают инсулинорезистентность (ИР), нарушение секреции инсулина, повышение продукции глюкозы печенью, а также наследственную предрасположенность и особенности образа жизни и питания, ведущие к ожирению.
Роль наследственности в развитии СД типа 2 не вызывает сомнения. Многолетние исследования показали, что у монозиготных близнецов конкордантность для СД типа 2 приближается к 100%. Гиподинамия и избыточное питание приводят к развитию ожирения, усугубляя тем самым генетически детерминированную ИР и способствуя реализации генетических дефектов, которые непосредственно ответственны за развитие СД типа 2.
Ожирение, особенно висцеральное (центральное, андроидное, абдоминальное), играет важную роль как в патогенезе ИР и связанных с ней метаболических расстройств, так и СД типа 2. Это обусловлено особенностями висцеральных адипоцитов, которые характеризуются сниженной чувствительностью к антилиполитическому действию инсулина и повышенной чувствительностью к липолитическому действию катехоламинов. В связи с этим в висцеральной жировой ткани активизируется процесс липолиза, что в свою очередь приводит к поступлению большого количества свободных жирных кислот (СЖК) в портальную циркуляцию, а затем - в системный кровоток. В печени СЖК препятствуют связыванию инсулина с гепатоцитами, что, с одной стороны, способствует системной гиперинсулинемии, а с другой - усугубляет ИР гепатоцитов и подавляет ингибирующий эффект гормона на печеночный глюконеогенез (ГНГ) и гликогенолиз. Последнее обстоятельство обусловливает повышенную продукцию глюкозы печенью. Высокая концентрация СЖК в периферическом кровотоке усугубляет ИР скелетных мышц и препятствует утилизации глюкозы миоцитами, что приводит к гипергликемии и компенсаторной гиперинсулинемии. Таким образом, формируется порочный круг: увеличение концентрации СЖК ведет к еще большей ИР на уровне жировой, мышечной и печеночной ткани, гиперинсулинемии, активации липолиза и еще большему нарастанию концентрации СЖК. Гиподинамия также усугубляет имеющуюся ИР, так как транслокация транспортеров глюкозы (ГЛЮТ-4) в мышечной ткани в состоянии покоя резко снижена.
Инсулинорезистентность, обычно имеющая место при СД типа 2, представляет собой состояние, характеризующееся недостаточным биологическим ответом клеток на инсулин при его достаточной концентрации в крови. В настоящее время ИР в большей степени связывают с нарушением действия инсулина на пострецепторном уровне, в частности со значительным снижением мембранной концентрации специфических транспортеров глюкозы (ГЛЮТ-4, ГЛЮТ-2, ГЛЮТ-1).
Одними из важнейших последствий ИР являются дислипопротеинемия, гиперинсулинемия, артериальная гипертензия и гипергликемия, которые в настоящее время рассматриваются как главные факторы риска развития атеросклероза.
Нарушение секреции инсулина у больных СД типа 2 обычно выявляется уже к моменту манифестации заболевания. Так, у больных снижена первая фаза секреции инсулина при внутривенной нагрузке глюкозой, отсрочен секреторный ответ на прием смешанной пищи, повышена концентрация проинсулина и продуктов его метаболизма, нарушена ритмика колебаний секреции инсулина. Возможно, что на раннем этапе нарушения толерантности к глюкозе ведущая роль в изменении секреции инсулина принадлежит повышению концентрации СЖК (феномен липотоксичности). В дальнейшем усугубление нарушения секреции инсулина и развитие с течением времени его относительного дефицита происходит под воздействием гипергликемии (феномен глюкозотоксичности). К тому же компенсаторные возможности b-клеток у лиц с ИР нередко ограничены в связи с генетическим дефектом глюкокиназы и/или транспортера глюкозы ГЛЮТ-2, ответственных за секрецию инсулина в ответ на стимуляцию глюкозой. Следовательно, достижение и поддержание нормогликемии будет не только замедлять темпы развития поздних осложнений СД типа 2, но и в некоторой степени препятствовать нарушению секреции инсулина.
Хроническая повышенная продукция глюкозы печенью является ранним звеном в патогенезе СД типа 2, приводящим, в частности, к гипергликемии натощак. Избыточный приток свободных жирных кислот (СЖК) в печень при липолизе висцерального жира стимулирует ГНГ за счет увеличения продукции ацетил-СоА, подавления активности гликогенсинтазы, а также избыточного образования лактата. Кроме того, избыток СЖК ингибируют захват и интернализацию инсулина гепатоцитами, что усугубляет ИР гепатоцитов со всеми вытекающими последствиями.
Таким образом, суммируя изложенное, в настоящее время патогенез СД типа 2 можно представить в виде схемы (рис. 1).
Лечение
Подбор адекватной комплексной терапии и достижение компенсации заболевания у больных СД типа 2 представляет значительные трудности. Вероятнее всего это обусловлено значительной гетерогенностью СД типа 2, что затрудняет подбор оптимального с патогенетической точки зрения лечения в каждом конкретном случае.
Для достижения компенсации СД типа 2 назначенная терапия должна максимально воздействовать на все известные звенья патогенеза данного заболевания.
Прежде всего больные должны быть обучены принципам терапии СД типа 2, соблюдать низкокалорийную диету, по возможности расширять физическую нагрузку и иметь средства самоконтроля для гибкой коррекции сахароснижающих средств.
Однако в большинстве случаев, несмотря на строгое соблюдение диеты, для обеспечения компенсации заболевания, требуется назначение медикаментозной сахароснижающей терапии.
В настоящее время в лечении больных СД типа 2 используются ингибиторы a-глюкозидаз, метформин, средства, стимулирующие секрецию инсулина (производные сульфонилмочевины, производные бензойной кислоты), инсулин.
Ингибиторы a-глюкозидаз представляют собой псевдотетрасахариды (акарбоза) и псевдомоносахариды (миглитол). Механизм действия данных препаратов заключается в следующем: конкурируя с моно- и дисахаридами за места связывания на пищеварительных ферментах, они замедляют процессы последовательного расщепления и всасывания углеводов по всему тонкому кишечнику, что приводит к снижению уровня постпрандиальной гипергликемии и облегчает достижение компенсации углеводного обмена. В виде монотерапии ингибиторы a-глюкозидаз наиболее эффективны при нормальной гликемии натощак и незначительной посталиментарной гипергликемии, а также в комбинации с другими сахароснижающими препаратами. Основным побочным эффектом ингибиторов a-глюкозидаз являются метеоризм и диарея, в связи с чем они противопоказаны пациентам с язвенным колитом и грыжами различной локализации.
Производные сульфонилмочевины (ПСМ) являются обязательным звеном в комплексной терапии СД типа 2, так как с течением времени нарушение секреции инсулина b-клетками и его относительный дефицит наблюдается практически у всех больных СД типа 2.
ПСМ второй генерации
Международное название Суточная доза, мг Кратность приемов Содержание препарата в 1 таблетке, мг Глибенкамид 15-20 2 5
1,75 и 3,75Глипизид 2,5-20 1-3 5 Гликвидон 160-180 1-3 30 Гликлазид 80-320 1-2 80 Глимепирид 1-8 1 1,2,3,4,6
Механизм действия ПСМ связан со способностью последних стимулировать секрецию эндогенного инсулина, особенно в присутствии глюкозы. Препараты данной группы обладают способностью связываться со специфическими рецепторами на поверхности мембран b-клеток. Указанное связывание приводит к закрытию АТФ-зависимых калиевых каналов и деполяризации мембран b-клеток, что в свою очередь способствует открытию кальциевых каналов и быстрому поступлению кальция внутрь этих клеток. Данный процесс приводит к дегрануляции и секреции инсулина, в связи с чем его концентрация в крови и печени возрастает. Это способствует утилизации глюкозы гепатоцитами и периферическими клетками и снижению уровня гликемии.
В настоящее время в терапии больных СД типа 2 в основном применяются ПСМ второй генерации. По сравнению с ПСМ первой генерации они оказывают в 50-100 раз более выраженный сахароснижающий эффект, что позволяет использовать их в малых дозах.
Начинать терапию ПСМ второй генерации следует с минимальных доз, постепенно увеличивая дозу по мере необходимости. В каждом конкретном случае дозу препарата следует подбирать индивидуально, помня о высоком риске гипогликемических состояний у лиц пожилого и старческого возраста.
Глибенкламид обладает выраженным сахароснижающим эффектом, в связи с чем назначение его на ранних стадиях заболевания может привести к гипогликемическим состояниям. Микронизированные формы глибенкламида (1,75 и 3,5 мг) обладают высокой биодоступностью и низким риском развития гипогликемических состояний.
Глипизид также оказывает достаточно выраженный сахароснижающий эффект. При этом данный препарат представляет минимальную опасность в плане гипогликемических реакций. Указанное преимущество глипизида обусловлено отсутствием кумулятивного эффекта, поскольку образующиеся при его инактивации в печени метаболиты не обладают гипогликемизирующим действием. В настоящее время применяется новая пролонгированная ГИТС форма глипизида - глибенез ретард (глюкотрол XL) (GITS - гастроинтестинальная терапевтическая форма), которая обеспечивает оптимальное содержание препарата в крови при однократном приеме.
Гликвидон является сахароснижающим препаратом, назначение которого возможно у лиц с заболеваниями почек. Около 95% полученной дозы препарата выводится через желудочно-кишечный тракт и лишь 5% - через почки. Многоцентровое изучение действия гликвидона на функцию печени доказало возможность его безопасного применения у лиц с нарушением ее функции.
Гликлазид помимо сахароснижающего эффекта оказывает положительное влияние на микроциркуляцию, систему гемостаза, некоторые гематологические показатели и реологические свойства крови, что является крайне актуальным для больных СД типа 2. Перечисленные эффекты гликлазида обусловлены его способностью снижать степень агрегации тромбоцитов, увеличивая индекс их относительной дезагрегации, и вязкость крови.
Глимепирид - новый ПСМ, в отличие от всех вышеперечисленных препаратов, связывается с другим рецептором на мембране b-клетки. Указанное качество препарата проявляется в виде особенности его фармакокинетики и фармакодинамики. Так, при однократном применении глимепирида поддерживается его постоянная концентрация в крови, необходимая для обеспечения сахароснижающего эффекта в течение 24 ч. Особенности ассоциации глимепирида с рецептором способствуют быстрому наступлению сахароснижающего действия, а диссоциация с тем же рецептором - практически исключает риск гипогликемических состояний.
Побочные эффекты при применении ПСМ, как правило, наблюдаются в исключительных случаях и проявляются диспепсическими расстройствами, ощущениями металлического вкуса во рту, аллергическими реакциями, лейко- и тромбоцитопенией, агранулоцитозом. Перечисленные нежелательные последствия применения этих препаратов требуют снижения дозы или их полной отмены и практически не наблюдаются при использовании ПСМ второй генерации.
Противопоказанием для назначения ПСМ являются СД типа 1 и все его острые осложнения, беременность и лактация, почечная и печеночная недостаточность, присоединение острого инфекционного заболевания, обширные или полостные операции, прогрессирующее снижение массы тела больного при неудовлетворительных показателях состояния углеводного обмена, острые макроваскулярные осложнения (инфаркт миокарда, инсульт, гангрена).
Бигуаниды начали применяться в лечении больных СД типа 2 в те же годы, что и ПСМ. Однако в связи с частыми случаями возникновения лактацидоза при приеме фенформина и буформина производные гуанидина практически были исключены из терапии больных СД типа 2. Единственным препаратом, разрешенным к применению во многих странах, оставался метформин.
Анализ результатов лечения больных СД типа 2 в последнее десятилетие во всем мире показал, что назначение одних лишь ПСМ, как правило, недостаточно для достижения компенсации СД типа 2. Учитывая данное обстоятельство, в терапии больных СД типа 2 в последние годы вновь стал широко применяться метформин. Данному обстоятельству во многом способствовало приобретение новых знаний о механизме действия данного препарата. В частности, исследования последних лет показали, что риск летального повышения в крови уровня молочной кислоты на фоне длительного лечения метформином составляет всего лишь 0,084 случая на 1000 больных в год, что в десятки раз ниже риска развития тяжелых гипогликемических состояний при терапии ПСМ или инсулином. Соблюдение противопоказаний к назначению метформина исключает риск развития указанного побочного эффекта.
Механизм действия метформина коренным образом отличается от такового ПСМ, в связи с чем может успешно применяться как в виде монотерапии СД типа 2, так и в комбинации с последними и инсулином. Антигипергликемический эффект метформина прежде всего связан со снижением продукции глюкозы печенью. Описанное действие метформина обусловлено его способностью подавлять ГНГ, блокируя ферменты данного процесса в печени, а также продукцию СЖК и окисление жиров. Важным звеном в механизме действия метформина является его способность снижать имеющуюся при СД типа 2 ИР. Данный эффект препарата обусловлен способностью метформина активировать тирозинкиназу инсулинового рецептора и транслокацию ГЛЮТ-4 и ГЛЮТ-1 в мышечных клетках, стимулируя тем самым утилизацию глюкозы мышцами. Кроме того, метформин усиливает анаэробный гликолиз в тонком кишечнике, что замедляет процесс поступления глюкозы в кровь после приема пищи и снижает уровень постпрандиальной гипергликемии. Помимо перечисленного действия метформина на углеводный обмен следует подчеркнуть его положительное влияние на метаболизм липидов, что чрезвычайно важно при СД типа 2. Доказано положительное влияние метформина и на фибринолитические свойства крови за счет подавления ингибитора активатора плазминогена-1, уровень которого значительно повышен при СД типа 2.
Показаниями к применению метформина являются невозможность достижения компенсации заболевания у лиц с СД типа 2 (в первую очередь с ожирением) на фоне диетотерапии. Комбинация метформина и ПСМ способствует достижению лучших результатов лечения СД типа 2. Улучшение контроля СД при сочетании метформина и ПСМ обусловлено разнообразным типом воздействия этих лекарственных препаратов на патогенетические звенья СД типа 2. Назначение метформина больным СД типа 2, получающим инсулинотерапию, препятствует увеличению массы тела.
Начальная суточная доза метформина обычно составляет 500 мг. При необходимости через неделю от начала терапии при условии отсутствия побочных эффектов доза препарата может быть увеличена. Максимальная суточная доза метформина составляет 3000 мг. Принимают препарат вместе с едой.
Среди побочных эффектов действия метформина следует отметить лактацидоз, диарею и другие диспепсические явления, металлический вкус во рту, редко тошноту и анорексию, которые обычно быстро исчезают при снижении дозы. Упорная диарея является показанием для отмены метформина.
При длительном приеме метформина в больших дозах следует помнить о возможности снижения всасывания в желудочно-кишечном тракте витаминов В12 и фолиевой кислоты, а при необходимости в индивидуальном порядке решать вопрос о дополнительном назначении перечисленных витаминов.
Учитывая способность метформина усиливать анаэробный гликолиз в тонком кишечнике в сочетании с подавлением ГНГ в печени, следует контролировать содержание лактата в крови не реже 2 раз в году. При появлении жалоб со стороны больного на мышечные боли следует немедленно исследовать уровень лактата, а при возрастании содержания в крови последнего или креатинина лечение метформином следует прекратить.
Противопоказаниями к назначению метформина являются нарушение функции почек (снижение клиренса креатинина ниже 50 мл/мин или повышение креатинина в крови выше 1,5 ммоль/л), поскольку препарат практически не метаболизируется в организме и экскретируется почками в неизмененном виде, а также гипоксические состояния любой природы (недостаточность кровообращения, дыхательная недостаточность, анемия, инфекции), злоупотребление алкоголем, беременность, лактация и указание на наличие лактацидоза в анамнезе.
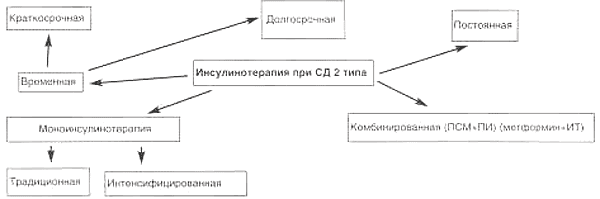
В случае невозможности достижения компенсации СД на фоне приема пероральных сахароснижающих препаратов (ПССП) рекомендуется перевод больных на комбинированную терапию ПСМ и/или метформином и инсулином, либо на монотерапию инсулином. По длительности применения и виду инсулинотерапию можно классифицировать следующим образом.
Временная краткосрочная инсулинотерапия обычно назначается при стрессовых ситуациях (ОИМ, ОНМК, операции, травмы, инфекции, воспалительные процессы и пр.) в связи с резким повышением потребности в инсулине в эти периоды. При выздоровлении и сохранении собственной секреции инсулина больной вновь переводится на обычную для него сахароснижающую терапию.
Повседневная сахароснижающая терапия в подавляющем большинстве случаев в этот период отменяется. Назначается инсулин короткого действия под контролем гликемии и пролонгированный инсулин перед сном. Количество инъекций инсулина зависит от уровня гликемии и состояния больного.
Временная долгосрочная инсулинотерапия назначается в следующих ситуациях:
- Для ликвидации состояния глюкозотоксичности до восстановления функции b-клеток.
- Наличие временных противопоказаний к приему ПССП (гепатит, беременность и пр.)
- Длительные воспалительные процессы (синдром диабетической стопы, обострение хронических заболеваний).
При наличии противопоказаний к приему ПССП повседневную сахароснижающую терапию отменяют, при отсутствии таковых ее можно сохранить. При наличии противопоказаний к приему ПССП перед завтраком и перед сном назначают пролонгированный инсулин. В случае постпрандиальной гипергликемии при данном лечении перед едой назначают инсулин короткого действия. При отсутствии противопоказаний к приему ПССП получаемые сахароснижающие препараты не отменяют, а перед сном и при необходимости перед завтраком назначают пролонгированный инсулин. По ликвидации глюкозотоксичности или выздоровлении больного переводят на обычную сахароснижающую терапию.
Постоянная инсулинотерапия назначается в следующих случаях:
- при истощении b-клеток и снижении как базальной, так и стимулированной секреции собственного инсулина (С-пептид базальный < 0,2 нмоль/л, С-пептид стимулированный < 0,6 нмоль/л);
- при наличии противопоказаний к применению ПССП (заболевания печени, почек, крови, индивидуальная непереносимость ПССП);
- при наличии противопоказаний или неэффективности метформина для нормализации гликемии натощак.
Повседневную сахароснижающую терапию отменяют. Назначают комбинацию инсулина короткого действия перед основными приемами пищи и пролонгированного инсулина перед сном и перед завтраком. При наличии противопоказаний или неэффективности метформина для нормализации гликемии натощак назначают комбинированную терапию в виде ПСМ днем и пролонгированного инсулина перед сном.
Показаниями к моноинсулинотерапии при СД типа 2 являются:
- дефицит инсулина, подтвержденный клинически и лабораторно;
- абсолютные противопоказания к применению ПССП (заболевания почек, печени, крови, беременность, лактация).
Моноинсулинотерапия при СД типа 2 может назначаться как в виде традиционной, так и в виде интенсифицированной инсулинотерапии.
Интенсифицированную ИТ можно назначать лишь больным с сохраненным интеллектом, прекрасно обученным принципам терапии СД, тактике поведения при неотложных состояниях, самоконтролю и в обязательном порядке имеющим средства для его осуществления. Учитывая, что интенсифицированная ИТ может увеличивать риск гипогликемических состояний, особенно опасных при наличии сердечно-сосудистых заболеваний, данный вид инсулинотерапии не рекомендуется лицам, перенесшим острый инфаркт миокарда, острое нарушение мозгового кровообращения, а также лицам с нестабильной стенокардией. Обычно таким больным назначают пролонгированный инсулин дважды в сутки, а дозу короткого инсулина устанавливают индивидуально в зависимости от планируемого к приему с пищей количества углеводов и уровня препрандиальной гликемии.
Современные критерии компенсации СД типа 2, предложенные European NIDDM Policy Group (1993), предполагают гликемию натощак ниже 6,1 ммоль/л, а через 2 ч после приема пищи - ниже 8,1 ммоль/л, гликированный гемоглобин HbA1С ниже 6,5%, аглюкозурию, акетонурию, нормолипидемию, АД ниже 140/90 мм рт. ст., индекс массы тела ниже 25.
Достижение компенсации СД типа 2 осуществляется в несколько этапов. На первом этапе лечения ликвидируется декомпенсация заболевания (гликемия натощак ниже 7,8 , а после еды ниже 10,0 ммоль/л). Доказано, что, с одной стороны, указанная гликемия уже снижает проявление глюкозотоксичности и способствует нормализации секреции инсулина, а с другой - при таком уровне гликемии натощак практически полностью исключается риск развития гипогликемических эпизодов, особенно в самое опасное ночное время.
Следующим важным этапом лечения больных являлось решение вопроса об индивидуальных критериях компенсации заболевания у каждого конкретного пациента.
Известно, что одним из критериев компенсации СД типа 2 является гликемия натощак ниже 6,1 ммоль/л. В то же время широко распространено мнение, что у лиц пожилого возраста критерии компенсации могут быть менее жесткими, учитывая опасность возникновения плохо распознаваемых ими гипогликемий. Однако не вызывает сомнения тот факт, что декомпенсация СД у лиц старческого возраста активизирует катаболические процессы, предрасполагает к развитию острых и ускоряет прогрессирование поздних осложнений СД. Десятилетнее наблюдение за пожилыми больными, страдающими СД типа 2, показало, что при декомпенсации заболевания частота инсультов и сердечно-сосудистых заболеваний резко возрастает, независимо от длительности заболевания (M.Uusitupa и соавт., 1993). При этом смертность от описанных причин прогрессивно увеличивается при возрастании HbA1С с 8,7% до 9,1% (J.Kuusisto, L.Mykkanen, K.Pyorala и соавт., 1994).
Анализ литературных данных и собственный опыт в достижении компенсации заболевания у больных СД типа 2 позволяет нам утверждать следующее: с нашей точки зрения, независимо от возраста больного, приоритетными позициями при выборе критериев компенсации в каждом конкретном случае являются сохранный интеллект пациента, наличие у него личных средств самоконтроля, ежедневный контроль гликемии и высокий уровень знаний, позволяющий больному принимать правильное решение на основании полученных им при самоконтроле данных. В том случае, если больной соответствует перечисленным критериям и, кроме того, в анамнезе у него отсутствуют данные о нестабильной стенокардии, перенесенном остром нарушении мозгового кровообращения или инфаркте миокарда, следует постепенно переходить к следующей цели терапии - достижению уровня гликемии натощак ниже 6,1 ммоль/л.
Литература:
1. Gerich J.E. Is muscle the major site of insulin resistance in type 2 ( non-insulin-dependent) diabetes mellitus? Diabetologia 1991; 34: 607-10.
2. Barnett A.H. Insulin in the Management of type 2 Diabetes. Diabetes review international 1996; 5(1): 12-4.
3. Colwell JA. Should we use intensive insulin therapy after oral agent failure in type 2 diabetes? Diabetes Care Aug 1996; 19(8): 896-8.
4. Niskanen-L. Drug-Therapy - Insulin-Treatment in Elderly patients with Non-insulin-dependent Diabetes-Mellitus - A Double-Edged-Sword. Drugs & aging 1996; 8(Iss 3): 183-92.
5. Peuchant E., Delmas-Beauvieux M.-C., Couchouron A. et al. Short-term insulin therapy and normoglycemia: effects on erythrocyte lipid peroxidation in NIDDM patients. Diabetes Care Feb 1997; 20(2): 202-7.
6. Riddle MC. Evening insulin strategy. Diabetes Care 1990; 13: 676-86.
7. Rodier-M., Colette-C., Gouzes-C. et al. Effects of Insulin therapy upon Plasms-Lipid Fatty-Acids and Platelet-Aggregation in NIDDM with Secondary Failure to Oral Antidiabetic Agents. Diabetes research and clinical practice 1995; 28(Iss.): 19-28.
8. Yki-JКrvinen H., Kauppila M., Kujansuu E. et al. Comparison of insulin regiments in patients with non-insulin dependent diabetes mellitus. N Engl J Med 1992; 327(12): 1426-33.
9 off G. The management of non-insulin dependent diabetes mellitus in the elderly. J of Family Practice. 1993 Mar; 36(3): 329-35.
10. Klein R.,. Klein BEK., Moss SE. et al. The medical management of hyperglycemia over a 10-year in people with diabetes. Diabetes Care Jul 1996; 19(7): 744-50.
11. The U.K. Prospective Diabetes Study Group: U.K. Prospective Diabetes Study 16: overview of 6 years'therapy of type II diabetes: a progressive disease. Diabetes 1995; 44: 1249-58.
12. Kuusisto J. Mykkanen L. Pyorala K. et al. NIDDM and its metabolic control predict coronary heart disease in elderly subjects. Diabetes 1994; 43: 960-7.
13. Kiiusisto J. Mykkanen L. Pyorala K. et al. NIDDM and its metabolic control are important predictors of stroke in elderly subjects. Stroke 1994; 25: 1157-64.Формин (метформин) -
| Июль 2005 г. |