Опубликовано в журнале:
«Сердечная Недостаточность» Том 14, № 2, 2013г.Сравнительная эффективность и безопасность длительного применения торасемида и фуросемида у больных с компенсированной сердечной недостаточностью.
Влияние на маркеры фиброза миокардаАгеев Ф. Т., Жубрина Е. С., Середенина Е. М, Титов В. Н., Масенко В. П., Коткина Т. И. - НИИ клинической кардиологии им. А. Л. Мясникова ФГБУ «РКНПК» МЗ РФ
Гиляревский С. Р., Голшмид М. В. Синицина И. И. - ГБОУ ДПО «РМАПО» МЗ РФ
Мареев В. Ю. - ФГБОУ ВПО «МГУ им. М. В. Ломоносова»,
Хосева Е. Н. - ГБОУ ВПО «Первый МГМУ имени И.М. Сеченова» МЗ РФ
Деев А. Д., Лукина Ю. В. - ФГБУ «ГНИЦПМ» МЗ РФ
Малишевский М. В., Рогожкина Ю. А. - ГБОУ ВПО «ТюмГМА» МЗ РФ
Сусликов А. В. - ФГБУЗ «БПНЦ РАН»Резюме
Актуальность. Применение петлевых диуретиков играет важную роль в терапии симптоматической ХСН.
Цель. Сравнительная оценка клинической эффективности торасемида (Тригрим®, Польфарма АО, Польша) и фуросемида (ОАО «Мосхимфармпрепараты им. Н. А. Семашко») у больных ХСН и их влияние на маркеры фиброза миокарда.
Материалы и методы. 108 больных с компенсированной ХСН II–III ФК (по NYHA), находившихся на стандартной терапии СН, были рандомизированы в группы получающих торасемид (n=55, средняя доза 9,8±5,9 мг) или фуросемид (n=53, средняя доза 28,7±14,7 мг). Исходно и спустя 6 месяцев терапии у всех больных проводилась оценка клинического и гемодинамического статуса, качества жизни и функцио нального состояния ЛЖ, а также определялись уровни показателей электролитного обмена, альдостерона, С-терминального пропептида проколлагена I типа (СICP), маркера синтеза коллагена I типа, и С-терминального телопептида коллагена I типа (CITP), маркера деградации коллагена I типа в сыворотке крови.
Результаты. Настоящее исследование показало безопасность и эффективность применения петлевых диуретиков торасемида и фуросемида в плане снижения среднего ФК и тяжести клинического состояния, повышения качества жизни больных умеренной компенсированной ХСН (все р<0,05). При этом лишь прием торасемида сопровождался достоверным увеличением дистанции 6-минутного теста ходьбы, ростом сократимости ЛЖ, улучшением допплеровских показателей, тесно связанных с давлением наполнения ЛЖ (Е / e') в сочетании со значительным снижением уровня NT-proBNP и альдостерона (все р<0,05). Терапия же фуросемидом ассоциировалась с достоверным ростом уровня маркера синтеза коллагена I типа, CICP, а также соотношения CICP / CITP (р<0,05).
Заключение. Настоящее исследование демонстрирует, что терапия как торасемидом, так и фуросемидом является безопасной и эффективной в плане снижения ФК и повышения качества жизни больных с компенсированной ХСН. Однако клинико-гемо-динамическая эффективность торасемида превосходит фуросемид, что, вероятно, связано с наличием у торасемида дополнительных антиальдостероновых механизмов влияния на функцию сердца, в том числе на процессы синтеза коллагена I типа.Ключевые слова: NT-proBNP, альдостерон, маркеры фиброза, петлевой диуретик, ХСН
Summary
Background. Te use of loop diuretics plays an important role in therapy for symptomatic CHF.
Aim. Comparative evaluation of clinical efcacy of torasemide (Trigrim®, Polpharma, Poland) and furosemide (N. A. Semashko Moskhimfarmpreparaty) in patients with CHF and effect of these therapies on markers of myocardial fibrosis.
Materials and methods. 108 patients with compensated II–III NYHA FC CHF receiving a standard therapy for HF were randomized to groups receiving torasemide (n=55; mean dose, 9.8±5.9 mg) or furosemide (n=53; mean dose, 28.7±14.7 mg). Clinical and hemodynamic status, quality of life, LV function, and serum levels of electrolytes, aldosterone, procollagen type I C-terminal propeptide (PICP), the marker of type I collagen synthesis, and С-terminal telopeptide of collagen type I (CITP), the marker collagen type I degradation.
Results. Study results demonstrated safety and efficacy of the loop diuretics, torasemide and furosemide, for reducing the average FC and severity of clinical condition and increasing the quality of life in patients with moderately compensated CHF (р<0.05 for all comparisons). However only the torasemide therapy was associated with significantly increased 6-min walk distance and LV contractility improved Doppler parameters of LV filling pressure (Е / e’) and considerably decreased NT-proBNP and aldosterone (р<0.05 for all comparisons). At the same time, the furosemide therapy was associated with significant increases in the type I collagen synthesis marker, PICP and the PICP / CITP ratio (р<0.05). Conclusion. This study showed that both torasemide and furosemide are safe and effective for decreasing the FC and increasing the quality of life in patients with compensated CHF. However the clinical hemodynamic effect of torasemide is superior to that of furosemide, probably due to additional antialdosterone mechanisms of torasemide, which may influence the heart function including synthesis of collagen type I.
Keywords: NT-proBNP, aldosterone, fibrosis markers, loop diuretic, CHF
Петлевые диуретики играют важную роль в терапии больных как острой, так и хронической СН [1, 2]. В условиях венозного застоя уменьшение объема циркулирующей крови на фоне диуретической терапии приводит к снижению диастолического давления в желудочках и к быстрому симптоматическому улучшению. Именно этот механизм долгое время рассматривался как единственный по влиянию данного класса препаратов на выраженность симптомов и качество жизни больных ХСН. При этом априори было принято считать, что более эффективным диуретиком является тот, который оказывает более мощное мочегонное влияние. Своеобразным «эталоном» мочегонного средства для лечения ХСН многие годы оставался петлевой диуретик фуросемид. Однако в 2002 году было завершено большое многоцентровое исследование TORIC, в котором фуросемид сравнивался с новым петлевым диуретиком торасемидом у больных с клинически выраженной СН. В этом исследовании торасемид достоверно превзошел фуросемид не только по способности улучшать клинико-функциональное состояние, но и по влиянию на смертность больных ХСН, хотя это и не было запланированной конечной точкой [3].Механизмы благоприятного влияния торасемида на течение ХСН еще не до конца определены, но, вероятнее всего, связаны с дополнительными (не диуретическими) свойствами этого препарата. Так, в отличие от фуросемида, торасемид показал способность положительно влиять на активность РААС [4, 5]. В исследованиях in vitro торасемид ингибировал АII индуцированную вазоконстрикцию и стимулировал сосудистые ростовые процессы, а также уменьшал выработку альдостерона и препятствовал его связыванию с соответствующими рецепторами [6–10]. При этом антиальдостероновое действие торасемида представляется особенно важным, поскольку в соответствии с современными представлениями альдостерону отводится ключевая роль не только в развитии электролитных расстройств, но и в прогрессировании фибротических процессов в миокарде и в снижении его податливости, что приводит к появлению и прогрессированию как диастолической, так и систолической дисфункции сердца. Именно этот факт позволяет объяснять превосходство торасемида перед другими диуретиками по влиянию на течение заболевания и, возможно, прогноз больных ХСН.
С клинической же точки зрения такое комбинированное мочегонное и антиальдостероновое действие торасемида может быть наиболее ценно на этапе поддерживающей диуретической терапии, в условиях не столько стационарного, сколько амбулатарно-поликлинического ведения больных ХСН.
Доказано, что неадекватная терапия мочегонными (чаще всего фуросемидом), использование малых доз препарата и режима «выходного дня», когда акцент терапии переносится на субботу–воскресенье, вызванные опасением врачей развития чрезмерной дегидратации и гипокалиемии, является одной из наиболее частых причин декомпенсации СН [11–13]. Уникальные свойства торасемида, включая благоприятный для амбулаторного приема фармакокинетический профиль (бoльшее время полувыведения и продолжительности действия, а также более высокая биодоступность по сравнению с фуросемидом), могут позволить преодолеть эти трудности и опасения поддерживающей диуретической терапии [14, 15].
Целью настоящего исследования было сравнение безо пасности длительной терапии и влияния торасемида (Тригрим®, Польфарма АО, Польша) и фуросемида (ОАО «Мосхимфармпрепараты им. Н. А. Семашко») на течение заболевания и качество жизни, функцию ЛЖ и уровень N-концевого фрагмента предшественника мозгового натрийуретического пептида (NT-proBNP), а также на содержание альдостерона и биохимических маркеров баланса коллагена I типа у пациентов с компенсированной ХСН без очевидных признаков задержки жидкости в организме и не нуждающихся во внутривенном введении петлевых диуретиков.
Материалы и методы
В исследование были включены 108 больных старше 18 лет с признаками умеренной или тяжелой ХСН, несмотря на прием стандартной терапии по поводу ХСН, и при наличии в анамнезе данных о задержке жидкости в организме, потребовавших в свое время госпитализации и / или внутривенного применения диуретиков. При этом получаемая на момент включения в исследование терапия ХСН должна была быть стабильной (по группам используемых препаратов) на протяжении, по меньшей мере, 6 последних месяцев.
В исследование не включались больные с клиническими признаками очевидной задержки жидкости в организме на момент включения: отеками нижних конечностей, гепатомегалией, набуханием шейных вен, влажными хрипами в легких, требующими внутривенного введения петлевых диуретиков. Критериями невключения также были: клинические признаки гиповолемии, гипокалиемии (уровень калия <3,5 ммоль / л) при отсутствии мочегонной терапии; постоянная форма мерцательной аритмии или трепетания предсердий с ЧСС более 120 мин –1; гемодинамически значимые поражения клапанного аппарата сердца; констриктивный перикардит или гемодинамически значимый перикардиальный выпот; легочное сердце или другие заболевания, связанные с изолированной правожелудочковой недостаточностью; ОКС или реваскуляризация миокарда менее чем за 3 месяца до включения больного в исследование; состояния, сопровождающиеся изменением содержания маркеров баланса коллагена (заболевания соединительной ткани, онкологические, ревматологические заболевания, выраженный фиброз печени, легких, клинически выраженный гипо- / гипертиреоз); умеренная / выраженная дисфункция почек (креатинин в сыворотке >130 мкмоль / л).
От каждого больного было получено письменное информированное согласие на добровольное участие в исследовании.
Всем больным проводились клиническое обследование с определением ФК ХСН по NYHA, тяжести клинического состояния с использованием шкалы оценки клинического состояния (ШОКС), оценка качества жизни по данным Миннесотского опросника качества жизни MLHFQ. Всем больным регистрировалась ЭКГ в 12 отведениях, выполнялись трансторакальная ЭхоКГ и допплер–ЭхоКГ в покое, осуществлялся забор лабораторных образцов крови с целью определения уровней NT-proBNP, альдо-стерона и маркеров синтеза (С-терминального пропептида проколлагена I типа, CICP) и распада (С-терминальный телопептид коллагена I типа, CITP) коллагена I типа, показателей электролитного отмена, расчет клиренса креатинина по формуле MDRD.
Эхокардиографическое исследование выполнялось опытными специалистами, находящимися в неведении относительно получаемой больными терапии. Фракция выброса ЛЖ рассчитывалась по стандартной методике Simpson. Состояние диастолической функции ЛЖ оценивалось с помощью импульсного допплеровского исследования трансмитрального кровотока и тканевого допплеровского исследования диастолического подъема основания ЛЖ. При этом определялись следующие показатели: соотношение максимальных скоростей раннего диастолического наполнения и наполнения в систолу предсердий (Е / А) и соотношение скорости Е к максимальной скорости диастолического подъема основания ЛЖ в раннюю диастолу (Е / e’) [16].
Уровень NT-proBNP в плазме определялся методом электрохемилюминисценции. Маркеры фиброза и альдостерона в плазме определялись иммуно-ферментным методом. Переносимость исследуемого препарата оценивалась по частоте возникновения гипокалиемии (<3,5 ммоль / л) и признаков фиксации сердечного выброса (появление слабости, вялости, тахикардии, ортостатической гипотонии; снижения АД; клинически значимого повышения уровня креатинина плазмы и развития олигурии).
В рамках оценки безопасности исследования отслеживались любые нежелательные явления, а также серьезные нежелательные явления (смерть больного; угроза жизни больного; явление, требующее госпитализации или продления текущей госпитализации; приводящее к стойкой и значительной нетрудоспособности и / или инвалидности; приводящее к появлению врожденных аномалий). Нежелательным считался любой негативный признак, симптом или медицинское состояние (заболевание), развивающееся после начала приема исследуемого препарата и не обязательно имеющее причинно-следственную связь с лечением (препаратом).
Дизайн исследования
Все больные, подошедшие по критериям включения / исключения для участия в исследовании, в день скрининга / рандомизации (визит 0) были случайным образом распределены в группу приема торасемида 10-20 мг / сут (n=55) или в группу приема фуросемида 10-80 мг / сут (n=53). Стартовая доза исследуемого препарата выбиралась в зависимости от характера используемой мочегонной терапии на момент включения. Помимо исследуемых препаратов, все больные принимали средства стандартной терапии по поводу ХСН (иАПФ или блокаторы ангиотензиновых рецепторов в оптимальной дозе и β-адреноблокаторы в обязательном порядке; антагонисты альдостерона, сердечные гликозиды по показаниям). Титрование дозы петлевых диуретиков осуществлялось на визите 1. При этом на визитах 1 (7-14 дней) и 2 (3 месяца) проводилось клиническое обследование и осуществлялся забор крови, а на финальном визите 3 (6 месяцев), помимо этого, выполнялась и трансторакальная ЭхоКГ в покое (рис. 1).
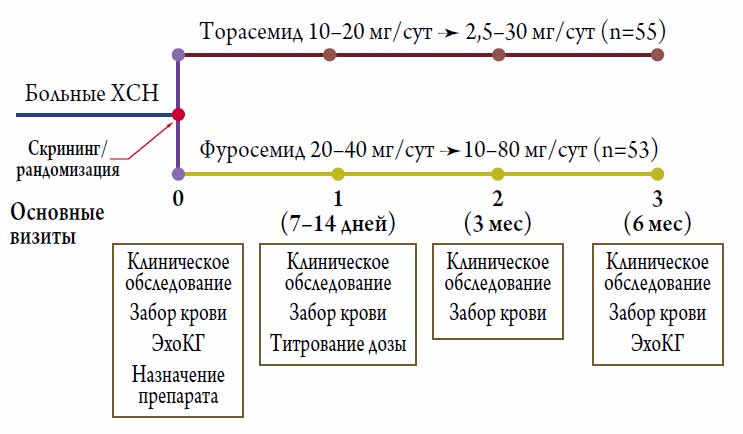
Рисунок 1. Дизайн исследования
Достигнутые средние дозы для обоих препаратов были клинически сопоставимы и составили: 9,8±5,9 мг для торасемида и 28,7±14,7 мг для фуросемида (соотношение средних доз торасемида и фуросемида примерно 1:3).
Статистическая обработка результатов
Статистический анализ полученных результатов проводили с помощью пакета прикладных статистических программ SAS 6.12 (Statistical Analisis System, США). Статистически значимыми считали различия, если вероятность абсолютно случайного их характера не превышала 5 % (p<0,05).
Таблица 1.
Исходная характеристика больных, распределенных в группы торасемида и фуросемида
Показатель Торасемид
(n=55)Фуросемид
(n=53)р Клинические данные Возраст, лет 65±8 66±7 н.д. Мужчины / женщины, % 23 (42 %) /
32 (58 %)26 (49 %) /
27 (51 %)н.д. Длительность ХСН, лет 4,8±4,3 5,3±3,7 н.д. Ишемическая / неишемическая этиология СН,% 26 (47 %) /
29 (53 %)23 (43 %) /
30 (57 %)н.д. Средний ФК ХСН, баллы 2,56±0,5 2,26±0,68 н.д. 6-минутный тест ходьбы, м 298±71 289±92 н.д. Миннесотский вопросник качества жизни, баллы 48±15 47±18 н.д. Шкала оценки клинического состояния ШОКС, баллы 4,9±2,9 4,2±2,3 н.д. ЧСС, мин –1 76±13 75±13 н.д. САД, мм рт. ст. 126±14 129±12 н.д. ДАД, мм рт. ст. 79±9 79±8 н.д. Инструментально-лабораторные данные ФВ ЛЖ, % 47±12 46±12 н.д. Е/Е’ 16,1±4,7 16,6±7,0 н.д. NT-proBNP, пг / мл 1598±3474 1855±4920 н.д. Терапия Ингибиторы АПФ, % 41 (74 %) 44 (83 %) н.д. БРА,% 14 (26 %) 9 (17 %) н.д. Петлевые диуретики, % 29 (52 %) 37 (69 %) н.д. Тиазидные диуретики, % 31 (56 %) 22 (41 %) н.д. Дигоксин, % 11 (20 %) 16 (30 %) н.д. Спиронолактон, % 40 (72 %) 41 (77 %) н.д. β-блокаторы, % 49 (89 %) 49 (92 %) н.д.
Данные представлены как среднее значение по группе ± стандартное отклонение среднего.Результаты
Исходная характеристика больных, распределенных в группы торасемида и фуросемида, представлена в таблице 1. По исходным демографическим, клиническим и ЭхоКГ показателям группы сравнения были сопоставимы друг с другом.
За время исследования выбыли 13 больных, из них по причине неблагоприятных событий – 3, из-за отказа от дальнейшего участия в исследовании – 10.
Бoльшее количество нежелательных событий, в т. ч. прогрессирование ХСН, ассоциировалось с терапией фуросемидом, однако статистической значимости данные различия не достигли (р=0,07) (рис. 2).
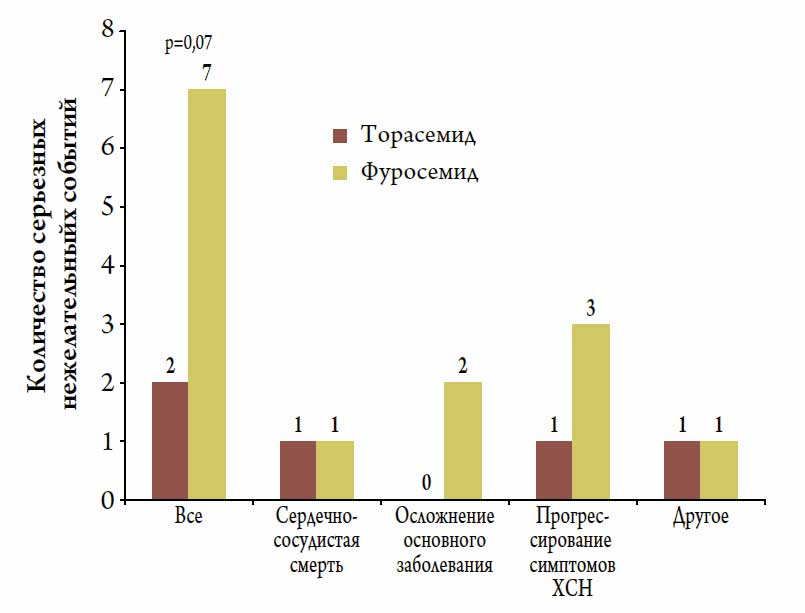
Рисунок 2. Частота развития серьезных нежелательных событий на фоне длительной терапии торасемидом и фуросемидом у пациентов с компенсированной ХСН II-III ФК
Влияние терапии торасемидом и фуросемидом на клинико-функциональный статус и качество жизни больных ХСН (табл. 2)
Терапия исследуемыми препаратами не сопровождалась клинически значимыми колебаниями АД и ЧСС.За время исследования в обеих группах произошло достоверное снижение среднего ФК NYHA в среднем на 12 % в группе торасемида и на 5 % в группе фуросемида (р<0,05 для обоих препаратов по сравнению с исходным уровнем, различия между группами не достоверны). При этом пропорции пациентов, улучшивших свой ФК, также достоверно не различались между сравниваемыми группами терапии (рис. 3).
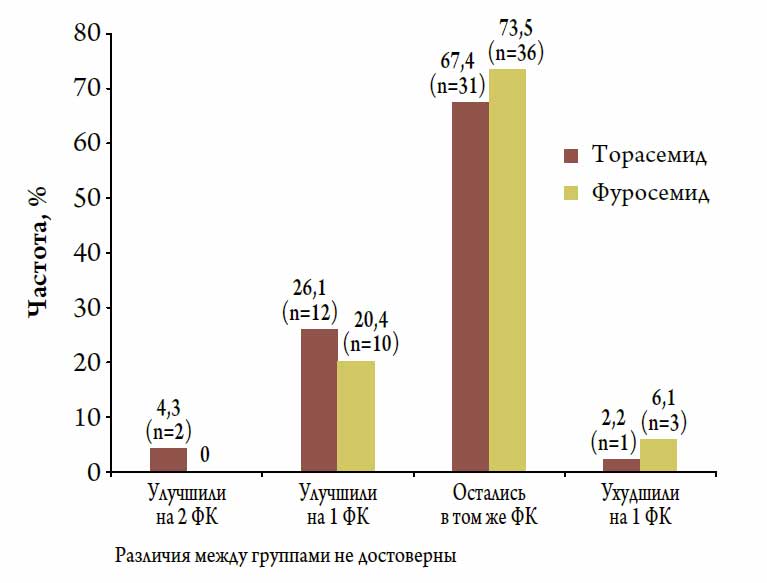
Рисунок 3. Динамика ФК (по NYHA) у пациентов с ХСН, получающих терапию торасемидом и фуросемидом
Кроме того, на фоне терапии как торасемидом, так и фуросемидом отмечалось достоверное (р<0,05) cнижение тяжести клинического состояния (по ШОКС) и улучшение качества жизни (по MLHFQ) больных ХСН, причем в бoльшей степени на фоне приема торасемида (различия между группами достоверны, р<0,05). Оба препарата повышали толерантность к физическим нагрузкам (по данным теста с 6-мин ходьбой), однако достоверно лишь в группе торасемида.
Таблица 2.
Динамика показателей клинико-функционального статуса, качества жизни, функции ЛЖ и уровня NT-proBNP
Показатель Торасемид (n=46) Фуросемид (n=49) р
групповых
динамикИсходно 6 месяцев Δ, % Исходно 6 месяцев Δ, % Средний ФК NYHA 2,56±0,50 2,26±0,68**** -11,9±22,3 2,51±0,50 2,37±0,64** -5,1±21,8 н.д. Шкала ШОКС, баллы 4,95±2,88 2,83±2,27**** -37,0±35,6 4,21±2,27 2,90±1,71**** -23,3±29,4 <0,05 6-минутный тест ходьбы, м 298±71 341±95*** +18,б±41,8 289±92 310±91 +25,6±86,7 н.д. Опросник MLHFQ, баллы 48±15 37±14**** -9,9±24,4 47±17 38±14**** -4,65±18,7 <0,05 САД, мм рт. ст. 126±14 125±12 -0,3±10,4 129±12 127±12 -0,7±8,9 н.д. ДАД, мм рт. ст. 79±9 79±8 +0,4±11,9 79±8 76±8 -2,2±12,9 н.д. ЧСС, мин -1 76±13 74±13 -1,1±14,1 75±13 75±14 +1,8±15,9 н.д. ИМТ, кг / м2 31,4±5,4 31,5±5,0 -0,6±3,4 30,5±5,9 30,3±5,9** -1,0±3,5 н.д. ФВ ЛЖ, % 47,5±12,5 50,9±10,5** +6,2±16,0 45,9±12,3 48,1±12,5* +6,7±19,7 н.д. КДО, мл 169,8±81,3 163,8±88,2 +0,02±28,8 161,5±67,1 154,б±69,2 -3,4±29,3 н.д. КСО, мл 96,5±72,8 86,4±54,9 +4,6±41,5 92,3±52,2 84,7±51,1* -2,4±36,1 н.д. Е / А 1,56±0,90 1,42±1,29 -1,5±28,4 1,29±0,64 1,41±0,45 28,2±18,3 н.д. Е /е’ 16,1±4,7 14,2±3,5** -5,8±23,8 16,6±7,0 16,1±5,9 +17,2±6,0 н.д. NT-proBNP, пг / мл 757
[185; 1379]451
[98; 1329]***-22,3
[-55,1; 4,4]769
[164; 1263]789
[1952; 1522]-4,9
[-37,9; 36,3]0,08 Калий, ммоль / л 4,59±0,54 4,45±0,55 -2,4±13,6 4,39±0,49 4,22±0,45* -2,9±10,7 н.д. Креатинин, мкмоль / л 86,6±26,3 85,4±19,3 +1,8±16,5 83,7±19,3 82,7±16,3 +2,7±20,5 н.д.
* - р<0,1, **— р<0,05, *** - р<0,01 и **** - р<0,001 по сравнению со значением показателя на начальным визите. Данные представлены как среднее значение по группе ± стандартное отклонение среднего, для NT-proBNP - как медиана по группе [нижний и верхний процентили].Влияние терапии торасемидом и фуросемидом на уровни альдостерона и маркеров распада и синтеза коллагена I типа у больных ХСН (табл. 3)
Лишь прием торасемида (но не фуросемида) приводил к достоверному и значительному снижению уровня альдостерона (в среднем на 22,6 %, p<0,001). И наоборот, только терапия фуросемидом ассоциировалась с достоверным повышением уровня маркера синтеза коллагена СIСP в среднем на 17,8 % (p<0,01). Достоверной динамики в содержании маркера распада коллагена С-концевого телопептида коллагена I (СITP) не было показано ни в одной из групп.Влияние терапии торасемидом и фуросемидом на функциональное состояние ЛЖ и уровень NT-proBNP (табл. 2)
За время исследования на фоне терапии торасемидом отмечалось достоверное повышение ФВ ЛЖ в среднем на 6,2 % (р<0,05), что сопровождалось достоверным и значительным снижением уровня NT-proBNP в среднем на 22,3 % (р<0,05). В группе же фуросемида, напротив, уровень NT-proBNP практически не изменился (различия между группами показали тенденцию к различию, однако не достигали статистической значимости, р=0,08). Кроме того, только на фоне терапии торасемидом имело место достоверное (р<0,05) улучшение показателя диастолической функции сердца - величины Е / e’, отражающей уровень давления наполнения ЛЖ.
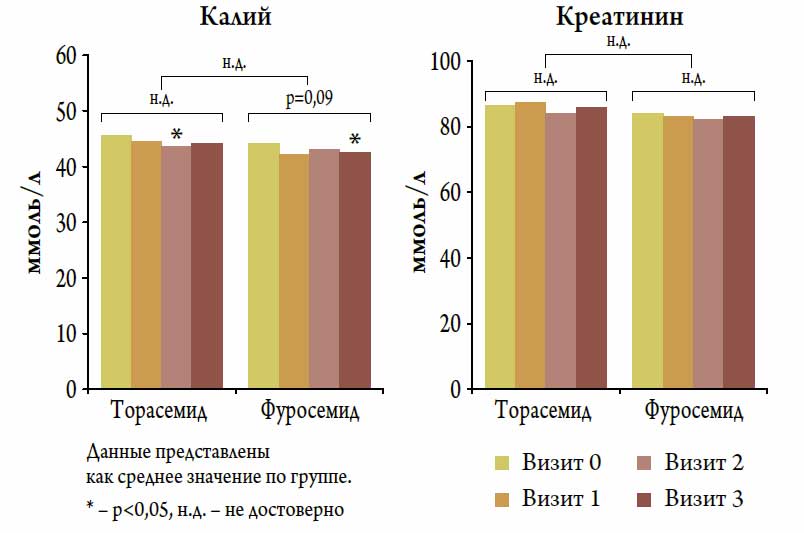
Рисунок 4. Повизитная динамика уровней калия и креатинина на фоне терапии торасемидом и фуросемидом
Влияние терапии торасемидом и фуросемидом на уровни калия и креатинина (табл. 2)
За время исследования в группе торасемида и фуросемида отмечалось незначительное и недостоверное снижение уровня калия плазмы в среднем на 2,4 % и 2,9 % соответственно (рис. 4). При этом частота случаев отклонения уровня калия от нормы (менее 3,5 ммоль / л и более 5,6 ммоль / л) была невелика и достоверно не отличалась между группами: 5 (10,8 %) случаев в группе торасемида и 3 (6,1 %) случая в группе фуросемида, р=0,2. Средний уровень креатинина в обеих группах также практически не менялся (рис. 4 и табл. 2).
Таблица 3.
Динамика уровней альдостерона и маркеров синтеза и распада коллагена I типа на фоне терапии торасемидом и фуросемидом
Показатель Торасемид (n=46) Фуросемид (n=49) р
групповых
динамикИсходно 6 месяцев Δ, % Исходно 6 месяцев Δ, % Альдостерон, пг/мл 235,4
[121,0; 452,5]168,5**
[119,4; 360]-22,6
[-72,9; 82,6]168,0
[84,9; 335,0]140,9
[73,9; 300,0]+12,5
[-49,9; 138,9]0,08 CICP, нг/мл 88,9
[60,3; 118,8]97,3
[82,4; 113,2]+13,9
[-13,8; 42,3]85,2
[69,1; 103,4]96,9**
[81,6; 118,2]+17,8
[-7,4; 60,5]н.д. CITP, нг/мл 0,29
[0,17; 0,47]0,27*
[0,10; 0,35]-14,9
[-53,5; 25,9]0,26
[0,15; 0,40]0,23
[0,14; 0,45]+7,7
[-29,0; 39,5]н.д. CICP/CITP 317
[211; 489]336
[278; 777]+7
[-17,4; 117,4]323
[200; 514]377**
[243; 740]+26,4
[-17,8; 60,8]н.д.
* – р<0,1, ** – р<0,05 по сравнению со значением показателя на начальным визите. Данные представлены как медиана по группе [нижний и верхний процентили].С целью более точного описания состояния коллагенового обмена нами были рассчитаны отношения СIСP / CITP для каждой группы больных. Увеличение этого соотношения в динамике свидетельствует в пользу смещения баланса коллагена в сторону его образования и, наоборот, уменьшение – в пользу его распада. На фоне терапии торасемидом не наблюдалось достоверной динамики этого показателя. В то же время применение фуросемида ассоциировалось с достоверным ростом этого соотношения на 26,4 % (р<0,05).
Обсуждение
Сравнительные исследования торасемида с другими диуретиками, главным образом с фуросемидом, при СН выполнялись и ранее, однако, как правило, с участием более тяжелых, декомпенсированных пациентов или в условиях стационара [3, 17, 18]. Так, в исследовании TORIC более 50 % больных имели III или IV (49,4 и 2,4 % соответственно) ФК по классификации NYHA [3].
Российское сравнительное исследование ДУЭЛЬ также проводилось в стационарных условиях у больных ХСН в основном с III ФК NYHA, с признаками застоя, требующих активной диуретической терапии [17]. Настоящее исследование стало одним из первых, целью которого было сравнение петлевых диуретиков у более легких и компенсированных больных (средний ФК составил 2,3–2,6 NYHA), не требующими внутривенного применения диуретиков, в условиях амбулаторной поддерживающей терапии.
Наши данные показали высокую эффективность и безопасность поддерживающего лечения компенсированных больных ХСН как фуросемидом, так и торасемидом, что обеспечивалось не только «мощностью» этих диуретиков, но и тщательным подбором их дозы под контролем клинического состояния, гемодинамики, функции почек и электролитов. Достигнутые средние дозы препаратов составили 9,8±5,9 мг для торасемида и 28,7±14,7 мг для фуросемида, что было несколько меньше, чем в исследовании ДУЭЛЬ (21,7 и 75,6 мг соответственно) и, вероятно, связано с тем, что в наше исследование включались более легкие больные, не нуждавшиеся в активной дегидратации. В исследовании TORIC, в котором тяжесть состояния больных ХСН была несколько выше, чем у нас, стартовая доза препаратов была также больше и составила 10 и 40 мг соответственно.
Тщательная титрация доз препаратов в нашей работе позволила минимизировать риск развития такого опасного осложнения, как клинически значимые гипо- или гиперкалиемия, которые за 6 месяцев терапии наблюдались лишь у 6,1 % больных в группе фуросемида и у 10,8 % больных в группе торасемида. Для сравнения: частота клинически значимых отклонений уровня калия в исследовании TORIC за 9,2 месяцев наблюдения составила 12,9 и 17,9 % на фоне торасемида и фуросемида соответственно. Следует добавить, что в отличие от больных в исследованиях ДУЭЛЬ и TORIC, в нашем исследовании до 75 % больных на старте получали терапию спиронолактоном.
Кроме того, такая стратегия назначения диуретиков позволила избежать другого опасного осложнения диуретической терапии - чрезмерного снижения давления наполнения ЛЖ с развитием синдрома фиксации сердечного выброса (СФСВ). СФСВ развивается вследствие избыточного диуреза и характеризуется снижением сердечного выброса и / или невозможностью его повышения при физической нагрузке. Клинически он проявляется слабостью, тахикардией, ортостатической гипотензией, а при выраженном снижении cердечного выброса - тяжелой гипотонией, повышением уровня креатинина и оли-гурией (преренальная азотемия) [19]. В рамках же нашего исследования прием как фуросемида, так и торасемида не сопровождался клинически значимым снижением АД или повышением ЧСС, а значительного повышения креатинина не было зарегистрировано ни у одного пациента.
Нами было показано, что терапия как торасемидом, так и фуросемидом улучшала клиническое состояние и качество жизни больных с умеренной компенсированной ХСН, что проявлялось примерно равным снижением среднего ФК по NYHA, баллов MLHFQ и ШОКС. Тем не менее детальный анализ выявил, что терапия торасемидом оказывает более выраженное положительное влияние на основные клинические показатели больных ХСН. Так, только при использовании торасемида отмечался достоверный прирост в дистанции 6-мин теста ходьбы, а также достоверное улучшение систолической (увеличение ФВ ЛЖ) и диастолической (отношение Е / е’) функции ЛЖ. Преимущество торасемида перед фуросемидом по влиянию на клиническое и функциональное состояние отмечалось и в ранее опубликованных работах [3, 17, 20-22]. Наше исследование стало одним из первых, в котором было показано, что амбулаторная терапия торасемидом, но не фуросемидом, приводит к достоверному снижению уровня NT-proBNP (-22 %), содержание которого тесно коррелирует с тяжестью клинического состояния и прогнозом у больных ХСН[23-25].
Необходимо отметить, что торасемид и фуросемид в рамках настоящего исследования использовались в эквивалентных по диуретической эффективности дозах в соотношении 1: 3 соответственно. Это позволило сделать вывод, что выявленное нами более благоприятное влияние торасемида на течение ХСН, вероятно, было связано с наличием у этого препарата дополнительных свойств, не связанных с его диуретическим действием.
Обеспечение адекватного прироста сердечного выброса при нагрузке является одной из жизнеобеспечивающих функций сердца и осуществляется в том числе за счет увеличения сократимости миокарда, обеспечиваемой механизмом Франка-Старлинга: увеличением давления наполнения ЛЖ с последующим растяжением кардиомиоцитов, приводящим к росту сократимости и сердечного выброса. Причем именно увеличение давления наполнения ЛЖ, несмотря на свою компенсаторную функцию, при развитии СН носит, как правило,чрезмерный характер, приводя к основным клиническим проявлениям ХСН и ассоциируясь с неблагоприятным прогнозом у данной категории больных [26].
Диуретический эффект петлевых диуретиков позволяет добиться быстрого уменьшения сердечной преднагрузки и давления наполнения ЛЖ. Если при этом удается добиться еще и улучшения механических свойств миокарда, в том числе за счет влияния на баланс миокардиального коллагена, то это приводит к еще большему (дополнительному) снижению давления наполнения ЛЖ. Если при этом удается добиться еще и улучшения механических свойств миокарда, в том числе за счет влияния на баланс миокардиального коллагена, то это приводит к еще большему (дополнительному) снижению давления наполнения ЛЖ. Для петлевых диуретиков такая способность прямо улучшать механические свойства миокарда описана только для торасемида. Исследования Lopez B. с применением метода эндомиокардиальной биопсии показали способность торасемида уменьшать объемную фракцию миокардиального коллагена и уровня С-концевого пептида проколлагена I типа [27]. Механизмы реализации такого положительного действия торасемида на состояние миокарда при ХСН, вероятнее всего, связаны с его самостоятельным модулирующим влиянием на активность нейро-гуморальных систем. В ряде исследований было показано, что в отличие от фуросемида торасемид уменьшает выработку альдостерона, а также препятствует его связыванию с соответствующими рецепторами [7-9], в том числе локально на уровне кардиомиоцитов [10].
Результаты нашего исследования также показали, что торасемид и фуросемид по-разному влияют на баланс коллагена. Так, прием фуросемида ассоциировался с достоверным повышением уровня маркера синтеза коллагена I типа CICP и сдвигом соотношения СICP / CITP в сторону увеличения. Это свидетельствовало о том, что применение фуросемида не сдерживало процессов фиброобразования и смещения баланса коллагена в сторону его синтеза. В то же время на фоне приема торасемида не отмечалось никакой негативной динамики ни одного из этих показателей, что могло свидетельствовать о том, что терапия торасемидом, как минимум, сдерживала негативные тенденции в обмене коллагена, свойственные течению СН.
Тот факт, что терапия торасемидом в нашем исследовании не сопровождалась ожидаемым снижением уровня CICP и соотношения СICP / CITP, возможно, связан с относительно коротким (6 мес) периодом наблюдения, недостаточным для оценки динамики фиброза. Тем не менее 6 месяцев лечения торасемидм оказалось достаточным для того, чтобы добиться отношения E / e’, наиболее тесно связанного с давлением наполнения ЛЖ [11]. Это, в свою очередь, перекликается с результатами ранее проведенных исследований, также продемонстрировавших более выраженное положительное влияние на диастолическую функцию ЛЖ торасемида по сравнению с фуросемидом [20, 28].
СПИСОК ЛИТЕРАТУРЫ
1. McMurray JJ, Adamopoulos S, Anker SD et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association(HFA) of the ESC. Eur Heart J. 2012;33 (14):1787-1847.
2. Национальные рекомендации ВНОК и ОССН по диагностике и лечению ХСН (третий пересмотр). Журнал Сердечная Недостаточность. 2010;11 (1):3-62.
3. Cosin J, Diez J. Torasemide in chronic heart failure: Results of the TORIC study. Eur J Heart Fail. 2002;4 (4):507-513.
4. Преображенский Д. В., Некрасова Н. И., Талызина И. В., Патарая С. А. Торасемид - петлевой диуретик нового поколения: особенности фармакологии и клиническая эффективность при сердечной недостаточности. Журнал Сердечная недостаточность. 2010;11 (5):294–300.
5. Friedel H, Buckley MM. Torasemide. A review of its pharmacology and therapeutic potential. Drugs. 1991;41 (1):81–103.
6. Fortuno A, Muniz P, Ravassa S et al. Torasemide inhibits angioten? sin II?induced vasoconstriction and intracellular calcium increase in the aorta of spontaneously hypertensive rats. Hypertension. 1999;34 (1):138–143.
7. Uchida T, Yamanaga K, Nishikawa M et al. Antialdosteronergic efect of torasemide. Eur J Pharmacol. 1991;205 (2):145–150.
8. Uchida T, Yananaga K, Kido H et al. Diuretic and vasodilating actions of torasemide. Cardiology. 1994;84 (Suppl 2):14–17.
9. Goodfriend TL, Ball DL, Oelkers W, Bahr V. Torasemide inhibits aldosterone secretion in vitro. Life Sci. 1998;63 (3):PL45–50.
10. Tsutamoto T, Sakai H, Wada A et al. Torasemide inhibits transcardiac extraction of aldosterone in patients with congestive heart failure. J Am Coll Cardiol. 2004;44 (11):2252–2253.
11. Brater DC. Diuretic therapy. N Engl J Med. 1998;339 (6):387–395.
12. Cody RJ, Kubo SH, Pickworth KK. Diuretic treatment for the sodium retention of congestive heart failure. Arch Intern Med. 1994;154 (17):1905–1914.
13. Беленков Ю. Н., Мареев В. Ю., Агеев Ф. Е. Хроническая сердечная недостаточность. Избранные лекции по кардиологии. – М.: «Гэотар-Медиа», 2006. – 432 с.
14. Brater DC. Benefts and risks of torasemide in congestive heart failure and essential hypertension. Drug Saf. 1996;14 (2):104–120.
15. Kido H, Ohtaki Y. Torasemide (LUPRC): a review of its pharmacological and clinical profle. Nihon Yakurigaku Zasshi. 2001;118 (2):97–105.
16. Nagueh SF, Appleton CP, Gillebert TC et al. Recommendations for the evaluation of lef ventricular diastolic function by echocardio? graphy. J Am Soc Echocardiogr. 2009;22 (2):107–133.
17. Мареев В. Ю., Выгодин В. А., Беленков Ю. Н. Диyретическая терапия Эффективными дозами пероральных диуретиков торасемида (диувера) и фуросемида в лечении больных с обострением Хронической Сердечной Недостаточности (ДУЭЛЬ– ХСН). Журнал Сердечная Недостаточность. 2011;12 (3):3–10.
18. Noe LL, Vreeland MG, Pezzella SM, Troter JP. A pharmacoeconomic assessment of torasemide and furosemide in the treatment of patients with congestive heart failure. Clin Ter. 1999;21 (5):854–866.
19. Opie L, Kaplan N. Diuretics. In: Opie L, Gersh B. (eds): Drugs for the heart (6th ed). Elsevier Saunders 2005; pp. 80–103.
20. Азизова А., Овчинников А., Агеев Ф. Сравнительное влияние торасемида и фуросемида на клинический статус и диастолическую функцию левого желудочка у больных с компенсированной сердечной недостаточностью и высоким давлением наполнения левого желудочка. Журнал Сердечная Недостаточность 2011;12 (6):326–332.
21. Muller K, Gamba G, Jaquet F, Hess B. Torasemide vs. furosemide in primary care patients with chronic heart failure NYHA II to IV – efcacy and quality of life. Eur J Heart Fail. 2003;5 (6):793–801.
22. Stauch M, Stiehl L. Controlled, double?blind clinical trial on the efcacy ans tolerance of torasemide in comparison with furosemide in patients with congestive heart failure – a multicenter study. In: Progress in Pharmacology and Clinical Pharmacology. Ed. By F. M. Eichelbaum et al. vol. 8. № 1. Stutgart New York. 1990. pp. 121–126.
23. Betencourt P. NT-proBNP and BNP: biomarkers for heart failure management. Eur J Heart Fail. 2004;6 (3):359–363.
24. Lee SC, Stevens TL, Sandberg SM et al. Te potential of brain natri-uretric peptide a biomarker for New York Heart Association class during the outpatient treatment of heart failure. J Card Fail. 2002;8 (3):149–154.
25. Koglin J, Pehlivanli S, Schwaiblmair M et al. Role of brain natriuretic peptide in risk stratifcation of patient with congestive heart failure. J Am Coll Cardiol. 2001;38 (7):1934–1941.
26. Meta-Analysis Research Group in Echocardiography (MeRGE) AMI Collaborators. Independent prognostic importance of a restrictive left ventricular flling pattern after myocardial infarction: an individual patient meta-analysis: Meta-Analysis Research Group in Echocardiography acute myocardial infarction. Circulation. 2008;117 (20):2591–2598.
27. Lopez B, Querejrta R, Gonzalez A et al. Effects of loop diuretics on myocardial fibrosis and collagen type I turnover in chronic heart failure. J Am Coll Cardiol. 2004;43 (11):2028–2035.
28. Yamato M, Sasaki T, Honda K. et al. Effects of torasemide on left ventricular function and neurohumoral factors in patients with chronic heart failure. Circ J. 2003;67 (5):384–390.
| Ноябрь 2013 г. |