В.А. Орлов, В.И. Соколова, В.А.Шендерович
Кафедра клинической фармакологии и терапии РМАПО МЗ РФСравнительное изучение препаратов цефтриаксона
«Офрамакс» 1000 мг производства фирмы Ranbaxy Labs (Индия) и препарата «Роцефин» 1000 мг производства фирмы F.Hoffmann - La Roche, (Швейцария)История создания цефалоспоринов берет свое начало с 1945 г., когда профессор бактериологии Cinsepni Brotzu выделил из культуры гриба Cephalosporium фильтрат, отличающийся по своим антибактериальным свойствам от пенициллина.
Цефалоспориновые антибиотики в настоящее время занимают одно из ведущих мест при лечении бактериальных инфекций различного генеза и различной локализации. Широкий спектр микробной активности, хорошие фармакокинетические свойства, низкая токсичность, синергизм с другими антибиотиками - делают цефалоспорины препаратами выбора при многих инфекционно-воспалительных заболеваниях. Группа цефалоспориновых антибиотиков насчитывает около 60 различных препаратов, которые принято разделять на генерации (или поколения). Цефалоспорины I поколения проявляли активность в основном к грамположительным и к некоторым грамотрицательным бактериям. Они не стабильны к гидролитическому действию β-лактамаз, разрушающих β -лактамное кольцо антибиотика, что приводит к потере антимикробной активности. Цефалоспорины II генерации обладают более высокой чувствительностью в отношении грамотрицательных бактерий, более широким спектром действия, но некоторой устойчивостью к действию β -лактамаз.
К III поколению цефалоспоринов относятся препараты, имеющие существенное отличие от предыдущих групп: высокая активность в отношении семейства Enterobacte-riaceae. гемофильной палочки, гонококков, менингококков, и меньшая - в отношении грамположительных микроорганизмов.
Одним из представителей цефалоспоринов III-поколения является цефтриаксон (офрамакс. "Ranbaxy", Индия). Цефтриаксон имеет более широкий спектр антимикробной активности. Отличается наилучшими фармакокинетическими показателями и самым продолжительным периодом полувыведения из всех известных цефалоспоринов III поколения. Это позволяет поддерживать терапевтические концентрации в течение 24 часов после однократной инъекции препарата в крови, тканях и биологических жидкостях [1.2]. Антибиотик обладает стабильностью по отношению к β -лактамазам и высокой проницаемостью через стенку грамотрицательных микроорганизмов. Известно, что цефтриаксон в основном (29% случаев) применяется в хирургической практике и в 16% антибиотик используется лечении инфекций респираторного тракта, причем с высокой клинической эффективностью [2,3]. В связи с наилучшими фармакокинетическими показателями цефтриаксона. препарат находит применение не только в стационарных условиях, но и в амбулаторной практике. С учетом всего вышеизложенного представилось целесообразным изучить "офрамакс" (цефтриаксон) на группе больных, лечившихся в клинике внутренних болезней.
Показания:
1.Острая бактериальная пневмония
2.Деструктивная пневмония (неясного генеза), кровохарканье.
3.Хронический бронхит, фаза обострения.
4.Сепсис (пролежни).
5.Сепсис. Инфекционный эндокардит.
6.Острый гайморит.
7.Энтероколит (иерсиниоз).
В процессе изучения цефтриаксона были определены следующие критерии использования антибиотика на больных с бронхолегочными заболеваниями, инфекционным эндокардитом (ИЭ), сепсисом, иерсиниозом и др. заболеваниями:
- оценка эффективности антибиотика;
- определение разовой (она же и суточная) дозы;
- оценка комбинированной терапии цефтриаксона с клиндамицином и амикацином;
- регистрация нежелательных явлений в процессе лечения пациентов.
Для решения поставленных задач использовались следующие методы:
- клинико-лабораторные показатели (исчезновение интоксикационного синдрома, изменение характера мокроты, урежение и изменение тембра кашля, общая картина крови и мочи, данные аускультативно-рентгенологического и компьютерная томография -(КТ - исследования);
- бактериоскопическое и бактериологическое исследование мокроты, крови, мочи и др. с идентификацией возбудителя и определение антибиотикограммы;
- биохимические показатели крови: билирубин, трансаминазы (ACT и АЛТ и гамма-ГТ), мочевина, креатинин крови, щелочная фосфатаза, общий белок и его фракции:
- изучение сыворотных концентраций - методом диффузии в агар с использованием в качестве индикаторной культуры B.subtilis-6633.
Микробиологическое исследование.
Клиническому применению цефтриаксона предшествовало определение возбудителей в биологическом материале. Идентификация микроорганизмов осуществлялась общепринятыми методами. Для определения чувствительности аэробов к цефтриаксону использовали диско-диффузионный метод (содержащий в диске 30 мкг/мл. цефтриаксона). Были изучены 170 культур, выделенных из мокроты, крови, гнойного отделяемого глаз, носа, уха, ран и зева больных, лечившихся в клинической больнице МПС РФ в течение февраля-апреля 1999 г. (см.таблицу 1,2). Антибиотикочувствительность микрофлоры мокроты, полученная от больных бронхолегочными заболеваниями приведена в таблице 1.
Таблица 1
Микрофлора мокроты от больных с бронхолегочными заболеваниями с определением антпбнограммы офрамакса, фирмы "Ranbaxy", Индия.
Возбудители
Число выделенных штаммов
Чувст.шт.
Количество штаммов
Слабо чувст.шт.
Резист.шт.
Streptococcus pneumoniae
59
59
2
1
S.aureus
6
5
1
-
Streptococcus viridans
1
-
-
1
Klebsiella pneumoniae
6
5
1
-
E.coli
9
6
1
2
Pseudomonas aeruginosae
3
2
1
-
Candida
5
-
-
5
Proteus
2
2
-
-
Итого:
91
(100%)
76
(84,2%)
6
(6,5%)
9
(9,7%)
-чувст.шт. - чувствительные штаммы; слабо чувст.шт. - слабо чувствительные штаммы; резист.шт. - резистентные штаммы
Изучена 91 культура из мокроты. При культуральном посеве наблюдался преимущественно рост Streptococcus pneumonia (59 шт.) из них 56 штаммов (94,9%) проявили активность к действию цефриаксона, 2 - культуры были умеренно чувствительны к антибиотику и лишь один штамм пневмококка оставался резистентным к изученному препа рату. В 6 - случаях высевался Staphylococcus aureus, который в основном был чувствителен к препарату. Одна культура Streptococcus viridans, была интактна к действию антибиотика.
Грамотрицательные возбудители, а именно: клебсиелла, кишечная, синегнойная палочки и др. возбудители в разной степени вошли в антибактериальный спектр действия цефтриаксона (см.таблицу 1). Примечательно, что среди штаммов Ps. aeruginosa 2 - культуры обладали чувствительностью к цефтриаксону и лишь 1 - изолят был умеренно активен к антибиотику. 5 - культур p.Candida характеризовались естественным уровнем резистентности. Итак, суммарная чувствительность к цефтриаксону различных микроорганизмов достаточна высокая и составляет 90,7%. Уровень резистентности изучаемых культур к цефтриаксону составил 9,7%, что соответствует данным литературы [3,4]. Дополнительно была изучена чувствительность 79-грамположительных и грамотрицательных возбудителей к офрамаксу "Ranbaxy", выделенных из мочи, крови, ран и т.д. Характер аэробной микрофлоры представлен в таблице 2. Анализ проведенных исследований показал, что преобладали грамположительные микроорганизмы, что и составило -55 (69.6%) культур, которые были активны к действию антибиотика в 38%, умеренная чувствительность проявлялась в 3.7% случаев. Примечательно, что все штаммы E.coli(20) и Proteus(4) были чувствительны к цефтриаксону.
Таблица 2.
Чувствительность клинических штаммов (гр+) и (гр-) бактерий к офрамаксу(метод дисков – 30 мкг/мл), фирма "Ranbaxv", Индия.
Микроорганизмы
Число культур
Офрамакс
Чуств.шт.
Слабо чувст.шт.
Резист.шт
Моча.
Staphylococcus epidermidis
5
4
1
-
Enterococcus
Proteus
E.coli
32
4
20
-
4
20
2
-
-
30
-
-
Кровь.
Staphylococcus aureus
1
1
-
-
Гнойное отделяемое из глаз.
Staphylococcus aureus
Staphylococcus epidermidis
3
2
3
2
-
-
-
-
Гнойное отделяемое из носа.
Staphylococcus epidermidis
1
1
-
-
Из уха.
Staphylococcus aureus
1
1
-
-
Раневая инфекция.
Staphylococcus aureus
Enterococcus
4
1
4
-
-
-
-
1
Зев.
Staphylococcus aureus
Staphylococcus viridans
Enterococcus
1
3
1
1
3
-
-
-
-
-
-
1
Итого:
79
(100%)
44
(55,6%)
3
(3,7%)
32
(40,5%)
чувст;шт. - чувствительные штаммы; слабо чувст.шт. - слабо чувствительные штаммы; резист.шт. - резистентные штаммы
В целом следует отметить, что как грам (+), так и грам (-) возбудители, выделенные из разного биоматериала были антибиотикочувствительны, что и составило 55,6%. Резистентность наблюдалась в 32 (40,5%) можно объяснить тем, что некоторые бактерии, в частности энтерококки приподно резистентны ко всем беталактамам [5].
С целью сравнительной характеристики чувствительности нами было проведено исследование микрофлоры мокроты и определение чувствительности к цефтриаксону (Роцефину фирмы F.Hoffmann - La Roche, Швейцария). Данные анализа чувствительности приведены в таблице 3.
Таблица 3
Чувствительность к цефтриаксону (фирма F.Hoffmann - La Roche, Швейцария) микроорганизмов,выделенных из мокроты больных бронхолегочной инфекцией.
Микроорганизмы
Количество культур
Из них
Чуств.шт.
Слабо чувст.шт.
Резист.шт
Streptococcus pneumoniae
33
30
1
2
Staphylococcus aureus
3
3
-
-
E.coli
2
1
1
-
Kl. pneumoniae
1
-
-
1
P. aeruginosae
1
-
-
1
Proteus
2
1
1
-
p.Candida
2
-
-
2
Всего:
44
(100%)
35
(81,8%)
3
(7%)
6
(13%)
При сравнительной микробиологической оценке отмечается, что в мокроте больных бронхолегочными заболеваниями также лидирует Streptococcus pneumoniae (см.таблицу 1,3). Значимых различий в спектре чувствительности микрофлоры к цефтриаксону (офрамаксу и роцефину) – не отмечено. Оба препарата обладали сходной антибиотикочувствительностью (84,2-81,8%). Следует отметить, что процент резистентных штаммов, выделенных из мокроты бронхолегочных больных, лечившихся роцефином был несколько выше в сравнении с офрамаксом и составил соответственно 13% - 9,7%.
Итак, существенных преимуществ в антимикробном спектре мокроты больных, лечившихся роцефином и офрамаксом не выявлено (см.таблицу 1,3).
Изучение фармакокинетики офрамакса.
Фармакокинетику изучали на 20 терапевтических больных после однократного внутривенного и внутримышечного введения в дозе 1 г в сутки.
После 30-минутной инфузии препарата средняя пиковая концентрация через 1 час составила 153,4 мкг\мл. Затем медленно снижаясь уровни концентрации оставались на достаточно высоких цифрах. Так, через 3 часа после внутривенного введения препарат определялся в сыворотке крови в киличестве – 89,6 мкг\мл, через 6 часов - 56 мкг\мл, через 12 часов – 28 мкг\мл и даже через 24 часа – 9,2 мкг\мл. Эти концентрации во много раз превышали показатели МПК для чувствительных к цефтриаксону микроорганизмов.
Однократное внутримышечное введение 1 г офрамакса выявило максимальную концентрацию через 2 часа – 80 мкг\мл, примерно половину от максимальной концентрации после внутривенного введения в той же дозе. Через 4, 6,12 и 24 часа определяли высокие концентрации, которые находились практически на одном уровне с наблюдаемыми после внутривенного применения препарата в те же сроки (таблица 4 и график).
Таблица 4.
Средние концентрации офрамакса в сыворотке крови больных после однократного внутривенного и внутримышечного введения в дозе 1 г.
Способ
введения
Часы
Концентрация в мкг\мл после введения через
1ч.
2ч.
3ч.
4ч.
6ч.
12ч.
24ч.
Внутривенно
Доверительные пределы
153,4
(114-192)
89,6
(82-96)
56
(56)
28
(26-30)
9,2
(7-12)
Внутримышечно
Доверительные пределы
80
(56-96)
66,5
(58-74)
54
(36-72)
32
(24-40)
10,5
(7-14)
График 1.
Средние концентрации офрамакса в сыворотке крови больных после однократного внутривенного и внутримышечного введения в дозе 1 г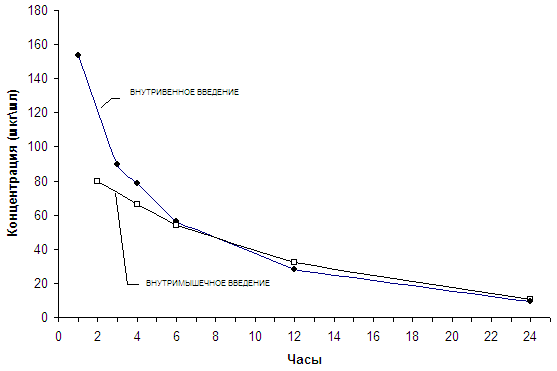
Цефтриаксон не метаболизируется в организме больного. 50% парентерально вводимой дозы выводится с мочой в активной форме в течение 48 часов. Скорость выведения цефтриаксона значительно снижена благодаря высокой степени связывания препарата белками сыворотки крови (95%), 10% выделяется желчью.
Длительный период полувыведения (Т 1\2- 5,47 – 7,6 часа) независит от пути введения намного превышая этот показатель для других цефалоспоринов, что позволяет поддерживать в течение 24 часов высокие концентрации и вводить препарат 1 раз в сутки. Такие высокие, длительно сохраняющиеся концентрации вполне достаточны для подавления большинства грамотрицательных и грамположительных микроорганизмов.
Площади под фармакокинетической кривой (AUC) также существенно не различаются (1004-1010), что свидетельствует об одинаковой биодоступности препарата, как при внутримышечном, так и при внутривенном введении.
Сравнительное изучение фармакокинетики цефтриаксона фирмы «Roche» - роцефина и офрамакса. фирмы "Ranbaxy" не выявило существенных различии в фармакокинетических показателях что позволило рекомендовать введение этих препаратов 1 раз в сутки, как в клинических, так и в амбулаторных условиях.
Так, при внутримышечном введении роцефина максимальная концентрация 92.3 мкг/мл достигается через 2 часа, а через 20-25 часов пределы колебания концентрации в сыворотке крови больных составляли 9-14 мкг/мл.
Фармакокинетическое изучение офрамакса в сыворотке крови выявило, что офрамакс не уступает по всем показателям роцефину, фирмы La Roche и характеризует его как эффективный антибиотик при бронхолегочной патологии и сепсисе.
Клиническая эффективность
Цефтриаксон (офрамакс) был применен на 20-ти больных с инфекцией различной локализацией (см.таблицу 5).
Инфекции дыхательных путей.
Лечение офрамаксом получали 4 больных с пневмококковой пневмонией и 1 больной - с деструктивной пневмонией неясного генеза (кровохарканье). Полное выздоровление отмечалось у 4 пациентов с острой пневмонией и у одного больного с деструкцией . легочной ткани - результаты лечения были негативными. Болезнь приняла затяжной характер, что сопровождалось обильным кровохарканьем, субфебрильной температурой, нарастающим анизоцитозом и пойкилоцитозом. Очевидно, причиной этого явилось позднее поступление в специализированный стационар и возможно ранее неадекватно проводимая антибиотикотерапия. а также иммунодефицитное состояние (потатор). Больной переведен в хирургическое торакальное отделение.
Таблица 5.
Клиническая эффективность офрамакса фирмы «Ranbaxy», Индия, в клинике внутренних болезней.
Диагноз
Количество
наблюдений
Клиническая переносимость и эффективность препарата
хорошая
удовл.
без эффекта
ПЭ
Острая пневмококковая пневмония
4
4
-
-
-
Деструктивная пневмония неясного генеза (кровохрюканье)
1
-
-
1
-
Обострение хронического бронхита (без выраженной обструкции)
10
8
2
-
-
Хронический деформирующий бронхит.
Синдром Картагенера1
-
-
-
1
Острый гаймарит
1
1
-
-
-
Болезнь Эбштейна. Сепсис.
1
-
-
1
-
Перелом шейки бедра, пролежени, сепсис.
1
1
-
-
-
Энтероколит (V.enterocolitica)
1
1
-
-
-
Всего:
20
(100%)
15
(75%)
2
(10%)
2
(10%)
1
(5%)
Хорошие результаты терапии были получены у больных с обострением хронического бронхита. Все 11 пациентов получали цефтриаксон 1,0 г/сут.(вм). Коррекция дозы во время лечения не проводилась, т.е.разовая доза 1,0 г - цефтриаксона, она же была и суточной. На этом фоне у 8 человек результаты лечения были положительными и лишь у 2 удовлетворительными. У одной больной с обострением хронического деформирующего бронхита (синдром Картагенера) после 2-х инъекций антибиотика развились нежелательные реакции (отек губ, зуд, чувство жжения в ротоглотке и т.д.). Цефтриаксон был отменен и с целью нивилирования побочных проявлений проводилась антигистаминная терапия. Вследствие короткого курса лечения и ранних проявлений нежелательных симптомов, оценить эффективность антибиотика не представилось возможным. В одном случае цефтриаксон был назначен при остром гайморите с хорошим клиническим результатом.
Гнойная инфекция кожи и мягких тканей.
Пациент Г... 85 лет с переломом шейки бедра, осложненным анаэробной инфекцией получал комбинированную антибиотикотерапию: цефтриаксон, клиндамицин, амикацин и иммунозаместительную терапию - биавен. При первичном бактериологическом исследовании из ран высеян Staphylococcus aureus чувствительный к цефтриаксону. Рост микрофлоры в крови не обнаружен. На фоне проводимой терапии быстро уменьшились общие симптомы интоксикации, "стихли" местные кожные проявления. Гнойного отделяемого из раны не наблюдалось. Кроме того, происходила нормализация лабораторных показателей, отражающих активность воспалительного процесса: достоверно снижалось количество лейкоцитов. СОЭ. Больной выписан из клиники в удовлетворительном состоянии.
Под наблюдением находился больной М...- 68 лет, по поводу сепсиса с полиорганным поражением, развившимся на фоне болезни Эбштейна, НКIII.
Неоднократные бактериологические посевы крови на выявление вида возбудителя были отрицательными. Проводилась эмпирическая антимикробная терапия: офрамаксом и клиндамицином. На этом фоне, после кратковременного улучшения, состояние у больного вновь ухудшилось -появились ознобы, повышение температуры и несколько увеличились отеки голеней. Вследствии чего произведена смена антибиотиков. В данной клинической ситуации судить о причинах неэффективности сложно, вследствии тяжести заболевания и отсутствия вида возбудителя. Вероятно, проводимую терапию можно расценивать как неудовлетворительную.
Иерсиниоз (Versinia enterocolitica).
Больной Т... - 38 лет. находился в клинике по поводу иерсиниоза. проявляющегося энтероколитом. Лечение проводилось офрамаксом с подтверждением микробиологического диагноза. Из кала выделен V.enterocolitica чувствительный к цефтриаксону. Антибиотик вводился внутривенно в суточной дозе 2,0 г
в течение 4-х недель. На фоне терапии офрамаксом нормализовался стул, температура, уменьшились вегетативные проявления. При повторном бактериологическом исследовании кала V.enterocolitica не высевалась. Таким образом, в данной клинической ситуации терапию офрамаксом можно расценивать как эффективную.С точки зрения сравнительной клинической эффективности нами проведено течение (роцефином) фирмы F.Hoffman - La Roche, на 26 больных с бронхолегочными заболеваниями. Хорошие и удовлетворительные результаты были получены у 20 пациентов (76%). В 6 клинических наблюдениях результаты лечения были безуспешными. Из них три человека были переведены в клинику туберкулеза (экссудативный плеврит, деструктивная пневмония, возможно, туберкулезной этиологии и один больной с неразрешающимся инфильтратом верхней доли). У троих пациентов лечение хронического бронхита было неэффективным, вероятно, из-за имеющегося вторичного иммунодефицита, а также отсутствия чувствительности высеваемого пневмококка к роцефину.
В литературе цефтриаксон характеризуется как антибиотик,обладающий хорошей переносимостью, хотя и он не избавлен от возможных побочных эффектов: повышение уровня ферментов и креатинина в крови, гемолитическая анемия, тромбоцитопения. аллергические кожные реакции, болезненность при внутримышечном введении. Ферментемию контролировали по аланинаминотрансферазе (ACT), аспартатаминотрансферазе (ACT), гаммаглютаминтрансферазе (ГГТ) и щелочной фосфатазе (ЩФ). На фоне лечения роцефином отмечено два случая повышения уровня АЛТ и по одному случаю ГГТ и ЩФ.
У двух человек на фоне лечения роцефином зарегистрирована легкая степень тромбоцитопении. Основная жалоба при введении роцефина и офрамакса, это болезненность в месте инъекции. Так, в одном случае при лечении офрамаксом наблюдали аллергическую реакцию (отек губ. жжение в ротоглотке и т.д.). Все явления быстро прошли на фоне антигистаминовой терапии.
Итак, на основании полученных данных следует признать, что изучаемые препараты офрамакс и роцефин обладают практически равной клинической эффективностью (на уровне 85% - 80% соответственно). Существенных преимуществ в антимикробном спектре не выявлено. Процент чувствительных культур, выделенных у больных при лечении офрамаксом и роцефином был идентичен. Частота нежелательных реакций у роцефина была выше, чем при лечении офрамаксом (15,3% и 5% соответственно).
Выводы:
1. Офрамакс характеризуется широким спектром антимикробного действия. Эффективен в отношении Str.pneumoniae ( процент чувствительных штаммов - 94,9) и семейства Enterobacteriaceae (процент чувствительных штаммов - 90), выделенных из мокроты больных бронхолегочными заболеваниями.
2. Максимальные концентрации офрамакса при внутривенном и внутримышечном введении в дозе 1г составили 153,4 мкг/мл и 80 мкг/мл, терапевтические концентрации сохранялись в течение 24 часов (9,2 -10,5 мкг/мл соответственно). Период полувыведения не зависит от пути введения и составляет 5.47 - 7,6 часа.
3. Сравнительное изучение фармакокинетики показало, что офрамакс не уступает роцефину как в уровнях максимальных концентраций (80 - 92 3 мкг/мл) так и в терапевтических концентрациях, которые поддерживаются в течение 24 часов (12 - 10,5 мкг/мл). что позволяет вводить препарат однократно.
4. Клиническая эффективность офрамакса и роцефина при бронхолегочнои патологии была идентичной (85 - 80%).
5. Хорошие результаты получены при лечении офрамаксом энтероколита, вызнанного versinia enterocolitica.
6. Нежелательные реакции у роцефина (транзиторная гиперферментемия. тромбоцитопения и повышение щелочной фосфотазы) выражены значительнее, чем у офрамакса (аллергический компонент в одном случае).
Зав.кафедрой клинической фармакологии и терапии РМАПО МЗ РФ,
Профессор В.А. ОРЛОВИсполнители:
ст.научн.сотр..к.м.н В.И. СОКОЛОВА
ст.научн.сотр..к.м.н В.А. ШЕНДЕРОВИЧЛитература
1. J.H.Yuk, C.H.Nightingale, R.Quintiliani, Clinical Pharmacokinetics of Ceftriaxone. Clin.Pharmacokinet. 17(4): 223-235, 1989.
2. K.Hell, Worldwide Clinical Experience with Ceftriaxone. Chemotherapy, 1989; 35: 228-235.
3. G.N.Karachalios, A.N.Georgiopoulos, S.Kanatakis, Treatment of Various Infections in an outpatient practice by intramuscular ceftriaxone: home parenteral therapy. Chemotherapy. 1989, 35:389-392.
4. С.В.Сидоренко, Антибиотикорезистентность в клинической практике. Труды II - Российского национального конгресса "Человек и лекарство", М., 1996. 78-94.
5. D.M.Livermore, Mechanisms of resistance to b-lactam antibiotics. Scand J Infect Dis 1991; 78:suppl: 7-16.
| Ноябрь 2005 г. |