Опубликовано в журнале: New England Journal of Medicine, 346: 92-98 (2002)
Сравнение четырех схем химиотерапии для лечения распространенного немелкоклеточного рака легкого
Дж.Г. Шиллер, Д. Харрингтон, Ч.П. Белам, К. Лангер, А. Сандлер, Дж. Крук, Дж. Жу и Д. Г. Джонсон от группы ECOG
Реферат
История вопроса.
Мы провели рандомизированное испытание в целью определить, будет ли какая-либо из трех схем химиотерапии превосходить комбинацию цисплатин/ паклитаксел у больных с распространенным немелкоклеточным раком легкого.
Методы.
1207 больных с распространенным немелкоклеточным раком легкого были рандомизированы на эталонную схему цисплатин/паклитаксел или на одну из трех экспериментальных схем: цисплатин/гемцитабин, цисплатин/доцетаксел или карбоплатин/паклитаксел.
Результаты.
Процент ответа для 11 больных, удовлетворяющих критериям испытания, составлял 19%, медианная выживаемость равнялась 7,9 месяца (95%-ный доверительный интервал [ДИ] от 7,3 до 8,5), годичная выживаемость 33% (95%-ный ДИ от 30 до 36%) и двухгодичная выживаемость 11% (95%-ный ДИ от 8 до 12%).
Процент ответа и выживаемость не отличались достоверно для больных, назначенных на лечение цисплатином/паклитакселом, и больных, назначенных на любую из трех экспериментальных схем. Лечение цисплатином и гемцитабином давало достоверно большее время до прогрессии заболевания по сравнению с лечением цисплатином и паклитакселом, однако давало большую вероятность почечной токсичности степени 3, 4 и 5 (у 9% больных по сравнению с 3% больных, получавших схему цисплатин/паклитаксел). Для больных с функциональным статусом 2 процент выживания был достоверно меньшии по сравнению с больными с функциональным статус 0 или 1.
Выводы.
Ни одна из четырех схем химиотерапии не давала достоверного преимущества по отношению к другим при лечении распространенного немелкоклеточного рака легкого.
* * *
Приблизительно треть всей онкологической смертности обусловлена раком легкого, который отвечает за большее количество летальных исходов каждый год, чем рак молочной железы, простаты и толстой кишки совместно. Медианная выживаемость для больных с нелеченым метастатическим немелкоклеточным раком легкого составляет всего лишь 4-5 месяцев, а процент выживания за 1 год всего лишь 10% [1].
Химиотерапия распространенного немелкоклеточного рака легкого часто считается неэффективной или слишком токсичной. Однако мета-анализы показали, что по сравнению с поддерживающим уходом химиотерапия дает небольшое преимущество по выживаемости у больных с немелкоклеточным раком легкого [2-4], Кроме того, рандомизированные испытания по сравнению химиотерапии с «наилучшим поддерживающим уходом» показали, что химиотерапия снижает симптоматику и улучшает качество жизни [5].
На протяжении последнего десятилетия появился ряд новых препаратов для лечения метастатического немелкоклеточного рака легкого, включая таксаны, гемцитабин и винорелбин. Комбинация одного или нескольких таких препаратов с препаратом платины дает более высокие проценты ответы и увеличивает выживаемость за 1 год, по данным исследований по фазе II [(6-10]. Однако, сравнения между этими более новыми схемами химиотерапии, которые часто используются в настоящее время, немногочисленны.
ECOG провела рандомизированное клиническое испытание по сравнению эффективности трех обычно используемых схем со стандартной схемой цисплатин/паклитаксел [11]. Главная цель испытания заключалась в том, чтобы сравнить общую выживаемость у больных, получающих лечение двойными комбинациями цисплатином/гемцитабином, цисплатином/доцетакселом, карбоплатином/паклитакселом и цисплатином/паклитакселом.
МЕТОДЫ
Больных с немелкоклеточным раком легкого на стадии IIIB (со злокачественным выпотом в плевру или перикард), стадии IV или с рецидивом заболевания рандомизировали в одну из четырех групп лечения (Рис. 1). Первая группа получала стандартное лечение: 135 мг/м2 паклитаксела вводили на протяжении 24 часов в первый день с последующим введением цисплатина в дозе 75 мг/м2 в день 2. Курс повторяли один раз в 3 недели. Во второй группе гемцитабин в дозе 1000 мг/м2 вводили в дни 1, 8 и 15, а цисплатин в дозе 100 мг/м2 вводили в первый день 4-недельного курса.
Больные в третьей группе получали доцетаксел в дозе 75 мг/м2 и цисплатин в дозе 75 мг/м2 в день 1, курс повторяли один раз в 3 недели. Больные в четвертой группе получали паклитаксел в дозе 225 мг/м2 путем 3-часового вливания в день 1 с последующим вливанием карбоплатина в тот же день в дозе, рассчитанной для создания AUC равной 6. Курс повторяли раз в 3 недели. Больных стратифицировали в соответствии с функциональным статусом по ECOG (0-1 или 2, где больший балл говорит о больших нарушениях), потерей веса за предыдущие 6 месяцев (<5% или ≥5%), стадии заболевания (IIIB и IV, или рецидивирующее заболевание) и наличием или отсутствием метастазирования в мозг.
Критерии включения больных
Больные, ранее получавшие химиотерапию, не могли участвовать в испытании.
Критерии для включения в испытание включали подтвержденное заболевание, измеримое или неизмеримое; возраст не моложе 18 лет; достаточную функцию кроветворения (содержание лейкоцитов не менее 4000/мм3 и тромбоцитов не менее 100000/мм3); адекватную функцию печени (по критерию уровня билирубина не более 1,5 мг на децилитр, [или 25,6 мкмоля/литр]) и достаточную функцию почек (уровень креатинина не более 1,5 мг/децилитр, [или 132,6 мкмол/л]). Предшествующая лучевая терапия симптоматических очагов допускалась при условии, что индикаторные очаги (очаги, за которыми наблюдали, чтобы определить наличие ответа на лечение) не были облучены и что лучевая терапия была завершена до начала химиотерапии. Больные со стабильными метастазами в мозг могли участвовать в испытании. Все больные после информирования должны были предоставить согласие на участие.
Использовались стандартные критерии определения ответа [по ECOG]. Полный ответ определялся как отсутствие заболевания во всех известных локализациях, по крайней мере, в течение 4 недель. Частичный ответ определялся как 50%-ное снижение суммы произведений взаимно-перпендикулярных диаметров всех измеримых очагов, продолжавшееся, по крайней мере, 4 недель. Прогрессирующее заболевание определялось или как 25%-ное увеличение площади любого очага по сравнению с предыдущим измерением, или появление одного или нескольких новых очагов.
Выживание рассчитывали с даты записи в испытание до даты смерти или даты, когда о больном было последний раз известно, что он жив. Время до прогрессии заболевания рассчитывали, начиная с даты включения в испытание до даты регистрации прогрессии заболевания или смерти; данные о больных, которые были живы и не имели рецидива, снимались с учета (цензурировались) на дату последнего обследования.
Протокол был утвержден соответствующей комиссией по рассмотрению в каждом из участвовавших центров. Все больные после информирования представили письменное согласие на участие.
Статистический анализ
Основным учетным критерием было время выживания с момента включения в испытание. Первичный анализ, определенный протоколом, включал сравнение каждого из распределений по выживаемости для трех экспериментальных групп лечения с распределением для соответствующей контрольной эталонной группы с использованием двустороннего лог-рангового критерия [12]. Для контроля ошибки типа I (то есть для контроля на множественные сравнения) для каждого из сравнений использовалось номинальное двустороннее значение Р=0,016. Исследование было спланировано таким образом, чтобы дать 80%-ную возможность выявления увеличения медианной выживаемости в экспериментальных группах на 33%, то есть медианного выживания, составляющего 12 месяцев, поскольку по данным предыдущего испытания стандартная схема давала медианную выживаемость, равную 9 месяцам [11]. Полное разрешающая сила для выявления 33%-ного улучшения выживаемости потребовала бы всего приблизительно 1070 летальных исходов в четырех группах или 535 на одно попарное сравнение. На основании данных по включению больных и критерию участия для предыдущих испытаний ECOG мысчитали, что нам необходимо включить по 300 больных в каждую группу лечения на протяжении 30-месячного периода.
Промежуточные анализы в ходе испытания мониторировались комитетом по мониторингу данных ECOG. План испытания предполагал два промежуточных анализа и один окончательный анализ данных по выживаемости с использованием границы О’Брайена-Флеминга [13], когда имеется 33%, 67% и 100% ожидаемого количества летальных исходов.
Все приведенные значения Р являются двусторонними и были скорректированы на промежуточные анализы в соответствии с методом О’Брайена-Флеминга. Все распределения времени до события были оценены по методу Каплана-Мейера [14]. Все описанные сравнения в отношении сроков до наступления события проводились с использованием лог-рангового критерия. Категорийные данные, такие как данные о лечении, ответе и токсических эффектах, сравнивались для разных групп лечения с использованием точного критерия Фишера (15).
РЕЗУЛЬТАТЫ
В период с октября 1996 г. по май 1999 г. в испытание было включено всего 1207 больных. Медианный период наблюдения составлял 8,0 месяца. На 1 мая 2000 г.
умерло 1074 больных. Из 1207 больных, включенных в испытание, 52 (4,3%), как было обнаружено в последующем, не удовлетворяли критериям участия (Таблица 1).
Таблица 1. Характеристики больных
Характеристика
Цисплатин/ паклитаксел
(N=303)Цисплатин/ гемцитабин
(N=301)Цисплатин/ доцетаксел
(N=304)Карбоплатин/ паклитаксел
(N=299)Всего (N=1207)
Удовлетворяет критериям (больных)
288
288
289
290
1155
Не удовлетворяет* (больных)
15
13
15
9
82
Возраст (годы)
Медиана 62
64
63
63
63
Интервал 27-84
32-87
34-84
30-85
27-87
Пол (% больных)
Мужчины 64
62
63
62
63
Женщины 36
38
37
38
37
Функциональный статус (% больных)**
0 29
33
32
28
30
1 65
62
62
67
64
2 6
5
6
5
6
Метастазы в мозг (% б-ных)
12
14
13
12
13
Потеря веса (% больных)
<5% 67
67
67
66
67
≥5% 33
33
33
34
33
Этническая группа (% больных)
Белые 87
84
87
83
85
Черные 8
11
7
11
9
Прочие 5
5
6
6
6
Стадия заболевания (% больных)
IIIB
11
14
14
14
13
IV или рецидивирующее заболевание
89
86
86
86
87
*Причины, по которым больные были исключены из испытания: неправильная стадия (18 больных), гистологические данные, не соответствующие диагнозу немелкоклеточного рака легкого (7 больных), ранее проводившаяся химиотерапия (5 больных), недостаточная информация в отношении лабораторных анализов, рентгеновских данных или функционального статуса для документации соответствия критериям (5 больных), диагноз второго злокачественного заболевания (3 больных), лечение, не ключенное в протокол (3 больных), сопутствующие заболевания (3 больных), неудовлетворительный функциональный статус (3 больных), прогрессия заболевания до лечения (2 больных), отзыв согласия (1 больной) и прочее (2 больных).
**Более высокий балл указывает на большее нарушение.Клинические характеристики больных в четырех группах были одинаковыми (Таблица 1). Медианный возраст составлял 63 года. Почти две трети больных были мужского пола. Шестьдесят четыре процента больных имели функциональный статус 1, а у 13% присутствовали метастазы в мозг. Около двух третей больных имели потерю веса менее 5% за предыдущие 6 месяцев. У большинства (87%) заболевание было на стадии IV или имел место рецидив заболевания.
Медианная выживаемость для всех 1207 больных составляла 8,0 месяца; выживаемость за 1 год составляла 34%, а за 2 года - 12% (Таблица 2). Анализы по сравнению всей группы в 1207 больных с группой в 1155 больных, удовлетворяющих критериям участия в испытании, не выявили заметных различий в отношении процента ответа, выживаемости или времени до прогрессии заболевания.
Таблица 2. Результат для всех групп лечения совместно
*Более высокий балл указывает на большее нарушение.
Переменная
Число
больныхПроцент
ответа (%)Выживаемость
Медианное
время до
прогрессии
(мес)Медиана
(мес)1 год (%)
2 года (%)
Все больные 1207
19
8,0
34
12
3,7
Удовлетворяющие критериям больные
1155
19
7,9
33
11
3,6
Стадия заболевания
1155
IIIB
21
9,1
39
14
4,6
IV или рецидив
19
7,8
32
11
3.6
Пол
1155
Мужчины
19
7,4
30
10
3,5
Женщины
19
9,1
38
13
3,8
Функциональный статус*
1155
0
23
10,8**
42
16
4,3**
1
18
7,1
30
9
3,5
2
14
3,9
19
6
1,5
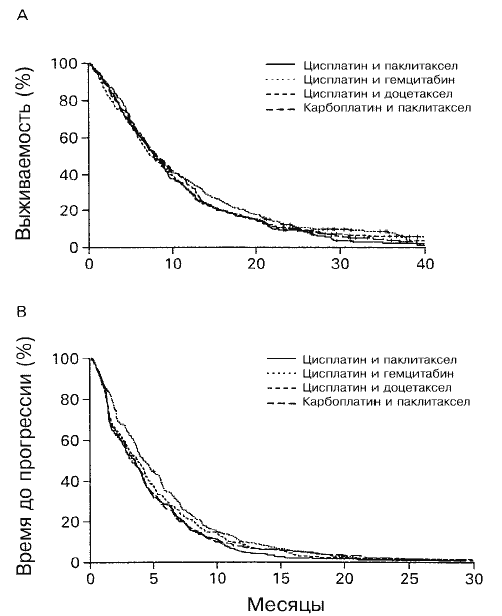
**P<0,001 по лог-ранговому критерию для сравнения с функциональным статусом 1 или 2.Общий процент ответа для 1155 больных, удовлетворяющих критериям испытания, составлял 19% (Таблица 3). В группе больных, получавших цисплатин и паклитаксел, медианная выживаемость составляла 7,8 месяца, а выживаемость через 1 год и 2 года составляла 31% и 10%, соответственно (Таблица 3 и Рис 2А). Не наблюдалось достоверных различий в отношении процента ответа или выживаемости для трех опытных групп. Медианная выживаемость составляла 8,1 месяца у больных, получавших цисплатин и гемцитабин, 7,4 месяца у больных, получавших цисплатин и доцетаксел, и 8,1 месяца у больных, получавших карбоплатин и паклитаксел (Таблица 3). Выживаемость для этих трех групп составляла 36%, 31% и 34%, соответственно, на срок в 1 год и 13%, 11% и 11% на срок в 2 года.
Таблица 3. Результат в зависимости от группы лечения*
*Проценты в сумме могут не давать 100 из-за округления. ДИ=доверительный интервал.
Характеристика
Цисплатин/
паклитаксел
(N=288)Цисплатин/
гемцитабин
(N=288)Цисплатин/
доцетаксел
(N=289)Карбоплатин/
паклитаксел
(N=290)Всего
(N=1155)Ответ - %
Полный ответ
<1
1
<1
<1
<1
Частичный ответ
21
21
17
16
19
Стабильное заболевание
18
18
25
23
21
Прогрессия заболевания
49
40
42
49
45
Не определен
13
20
16
11
15
Общий процент ответа
21
22
17
17
19
Выживаемость
Медиана (95% ДИ) – мес
7,8 (7,0-8,9)
8,1 97,2-9,4)
7,4 (6,6-8,8)
8,1 (7,0-9,5)
7,9 (7,3-8,5)
За 1 год (95% ДИ) - %
31 (26-36)
36 (31-42)
31 (26-36)
34 (29-40)
33 (30-36)
За 2 года (95% ДИ) - %
10 (5-12)
13 (7-15)
11 (7-14)
11 (7-14)
11 (8-12)
Медианное время до прогрессии (95% ДИ) – мес
3,4 (2,8-3,9)
4,2 (3,7-4,8)**
3,7 (2,9-4,2)
3,1 (2,8-3,9)
3,6 (3,3-3,9)
**Р=0,001 по лог-ранговому критерию для сравнения с цисплатином и паклитакселом.Медианное время до прогрессии составляло 3,4 месяца в группе цисплатин/паклитаксел и 4,2 месяца в группе цисплатин/гемцитабин (Р=0,01 по двустороннему лог-ранговому критерию) (Таблица 3). Медианное время до прогрессии в двух других группах экспериментального лечения не отличалось достоверно от группы цисплатин/паклитаксел (Рис. 2Б). Поскольку, согласно предписанию протокола, больных следовало оценивать на прогрессию заболевания после каждых двух курсов лечения, больные, получавшие цисплатин/доцетаксел или карбоплатин/паклитаксел, которые вводились курсами продолжительностью в 21 день, возможно, имели радиологические данные прогрессии заболевания раньше, чем больные, получавшие цисплатин/гемцитабин, которые вводились в форме курса продолжительностью в 28 дней. Однако на самом деле так не оказалось (данные не приведены).
В соответствии с исходным планом испытания, критериям для участия в испытании удовлетворяли как больные с функциональным статусом по ECOG равным 2, так и больные с функциональным статусом 0 или 1. Однако в октябре 1997 г. после того, как в испытание было включено 66 больных с функциональным статусом 2, план испытания был изменен с тем, чтобы включать только больных с функциональным статусом 0 или 1 из-за высокого процента серьезных побочных эффектов у больных с функциональным статусом 2 (16). Медианная выживаемость больных с функциональным статусом 0 составляла 10,8 месяца по сравнению с 7,1 месяца для больных с функциональным статусом 1 и 3,9 месяца для больных с функциональным статусом 2 (Р<0,001 по лог-ранговому критерию для обоих сравнений) (Таблица 2).
В Таблице 4 приведены токсические осложнения в четырех группах. Эти осложнения относились к типам, обычно связанным с комбинированной химиотерапией. Они были сходными в четырех группах с несколькими исключениями, отмеченными в таблице.
Таблица 4. Токсические эффекты*
Тип токсического
эффектаЦисплатин/
паклитаксел
(N=300)Цисплатин/
гемцитабин
(N=293)Цисплатин/
доцетаксел
(N=297)Карбоплатин/
паклитаксел
(N=293)% больных
Абсолютное количество нейтрофилов
Степень 3 18
24
21
20
Степень 4 57
39
48
43
Содержание тромбоцитов
Степень 3 4
22
2
8
Степень 4 2
28**
1
2
Анемия
Степень 3 12
27
13
9
Степень 4 1
1**
2
1
Инфекция
Степень 3 4
4
5
3
Степень 4 4
2
2
2
Степень 5 2
1
2
1
Фебрильная нейтропения
Степень 3 2
1
1
0
Степень 4 14
3**
10
4**
Кардиотоксические эффекты
Степень 3 2
1
1
1
Степень 4 0
3
2
1
Степень 5 1
1
2
1
Токсические эффекты на почки
Степень 3 3
6
3
1
Степень 4 0
2
0
0
Степень 5 0
1**
0
0
Тошнота
Степень 3 25
37
24
9**
Рвота
Степень 3 3
7
3
2
Степень 4 21
28
18
6**
Понос
Степень 3 1
1
2
1
Степень 4 6
2
8
1
Реакции гиперчувствительности
Степень 3 2
0
5
1
Степень 4 1
0
2**
1
Слабость
Степень 3 13
17
15
14
Степень 4 1
0
1
1
Нейропатия
Степень 3 5
9
5
10
Высший балл (все токсические эффекты)
2 19
21
23
28
4 68
68
61
53
5 5
4
6
4***
*Данные для всех больных, сообщивших о побочных эффектах, безотносительно к соответствию критериям участия в испытании.
**P<0,05 для суммы всех показанных степеней по сравнению с цисплатином/паклитакселом.
***P<0,05 для суммы степеней 4 и 5 по сравнению с цисплатином/паклитакселом.Пятьдесят три процента больных, получавших карбоплатин/паклитаксел, были сняты с испытания из-за прогрессии заболевания; в группе, получавшей цисплатин/паклитаксел, таких больных было 44% (Р<0,001). Двадцать семь процентов больных, получавших цисплатин/гемцитабин, было сняты с испытания из-за осложнений лечения по сравнению с 15% больных, получавших цисплатин/паклитаксел (P<0,001 по точному критерию Фишера).
ОБСУЖДЕНИЕ
Основанная на цисплатине химиотерапия метастатического немелкоклеточного рака легкого приводит к небольшому, но статистически достоверному улучшению выживаемости по сравнению с поддерживающим уходом [2-4]. Хотя более старые схемы химиотерапии (например, митомицин, ифосфамид и цисплатин) давали процент выживаемости, составлявший 10-15% на срок 1 год, схемы второго поколения (например, цисплатин и этопозид) в типичном случае давали процент выживания, составлявший 20-25% на срок в 1 год [1, 5, 17-20]. Наше испытание показало, что схемы третьего поколения дают выживаемость до 33% на срок в 1 год и 11% на срок в 2 года у больных с хорошим функциональным статусом.
Мы хотели определить, будет ли какая-либо из трех новых схем химиотерапии третьего поколения превосходить первую из этих схем третьего поколения, а именно схему цисплатин/паклитаксел, по проценту выживаемости. Однако, достоверных различий в выживаемости между больными, получавшими одну из трех экспериментальных схем, и больными, которые получали схему цисплатин/паклитаксел, не наблюдалось. Хотя время до прогрессии заболевания было более значительным в группе больных, получавших цисплатин/гемцитабин, по сравнению с другими группами, этот результат достигался на фоне большей почечной токсичности. С учетом отсутствия преимуществ в выживаемости на этой схеме и ее большей токсичности, клиническое значение увеличения срока до прогрессии сомнительно.
Токсичность является особенно серьезной проблемой у больных с неудовлетворительным функциональным статусом. Больные с функциональным статусом 2 стали исключаться из нашего испытания после того, как ранние результаты показали, что такие больные с большей вероятностью были подвержены побочным эффектам, включая летальный исход в пределах 30 дней от любой причины, по сравнению с больными с функциональным статусом 0 или 1. Поскольку роль химиотерапии в лечении распространенного немелкоклеточного рака легкого носит поддерживающий и паллиативный характер в лучшем случае, использование комбинированной химиотерапии на основе платины у больных с низким функциональным статусом не может быть рекомендовано в качестве стандарта.
Хотя в настоящем испытании мы не собирали данных относительно химиотерапии второй линии, возможно, что некоторые из наших больных были переведены на другую схему лечения, когда их заболевание прогрессировало. Влияние такого перевода на результаты настоящего испытания остается неизвестным. Мы также не сопоставляли экономическую эффективность четырех схем, что представляется потенциально важным с учетом различий в стоимости различных препаратов и затрат, связанных с их введением [21]. Наконец, в этом испытании мы также не оценивали качество жизни.
Хотя часто предполагается, что снижение токсичности снижает качество жизни, в недавнем испытании группы SWOG по сравнению цисплатина и винорелбина с карбоплатином и паклитакселом не наблюдалось различий в качестве жизни между двумя группами лечения, несмотря на достоверно более низкий процент токсических эффектов в группе больных, получавших карбоплатин и паклитаксел [21].
Мы делаем вывод, что схемы химиотерапии третьего поколения у больных с немелкоклеточным раком легкого с хорошим функциональным статусом могут в умеренной степени улучшать выживаемость на срок в 1 и 2 года. Заметных различий в выживаемости среди четырех использованных схем обнаружено не было, хотя схема карбоплатин/паклитаксел давала меньший процент токсических эффектов по сравнению с другими схемами. На основании этих результатов группа ECOG выбрала комбинацию карбоплатин/паклитаксел в качестве референс-схемы для будущих исследований.
Литература
1. Rapp E, Pacer JL, Willan A, et al. Chemotherapy can prolong survival in patients with advanced non-small-cell lung cancer — report of a Canadian multicenter randomized trial. J Clin Oncol 1988,6:633-41.
2. Marino P, Pampallona S, Preatoni A, Cantoni A, Invernizzi F. Chemotherapy vs.
supportive care in advanced non-small-cell lung cancer: results of a meta-analysis of the literature. Chest 1994,106:861-5.
3. Chemotherapy in non-small cell lung cancer: a meta-analysis using updated data on individual patients from 52 randomised clinical trials. BMJ 1995;311:899-909.
4. Grilli K, Oxman AD, Julian JA. Chemotherapy for advanced non-small cell lung cancer: how much benefit is enough? J Clin Oncol 1993,11:1866-72.
5. Cullen M, Billingham J, Woodraffe С, et al. Mitomycin, ifosfamide, and cisplatin in unresectable non-small-cell lung cancer: effects on survival and quality of life. J Clin Oncol 1999;17:3188'-94.
6. Sandler AB, Ansari R, McClean J, Fisher VV, Dorr A, Einhorn LH. A Hoosier Oncology Group phase II study of gemcitabine plus cisplatin in non-small cell lung cancer (NSCLC). Prog Proc Am Soc Clin Oncol 1995; 14:357. abstract.
7. Abratt RP, Bezwoda VVR, Goedhals L, Hacking DJ. A phase 2 study of gemcitabine with cisplatin in patients with non-small cell lung cancer. Prog Proc Am Soc Clin Oncol 1995,14:375. abstract.
8. Crino I, Scagliotti G, Marangolo M, ct al. Cisplatin-gemcitabine combination in non-small cell lung cancer (NSCLC): a phase II study. Prog Proc Am Soc Clin Oncol 1995,14:352. abstract.
9. Langer CI, Leighton JC, Comis RL, et al. Paclitaxel and carboplatin in combination in the treatment of advanced non-small-cell lung cancer: a Phase II toxicity, response, and survival analysis. J Clin Oncol 1995,13: 1860-70.
10. LeChevalier T, Belli L, Monnier A, et al. Phase II study of docetaxel (Taxotere) and cisplatin in advanced non small cell lung cancer (NSCLC): an interim analysis. Prog Proc Am Soc Clin Oncol 1995;14:350. abstract.
11. Bonomi P, Kim K, Fairclough D, et al. Comparison of survival and quality of life in advanced non-small-cell lung cancer patients treated with two dose levels of paclitaxel combined with cisplatin versus etoposide with cisplatin: results of an Eastern Cooperative Oncologv Group trial. J Clin Oncol 2000,18:623-31.
12. Mantel N. Evaluation of survival data and two new rank order statistics arising in its consideration. Cancer Chemother Rep 1966,50:163-70.
13. O'Brien PC, Fleming TR. A multiple testing procedure for clinical trials. Biometrics 1979,35:549-56.
14. Kaplan EL, Meier P. Nonparametric estimation of incomplete observations. J .Am Star Assoc 1958,53:457-81.
15. Cox DR, Snell EJ. Analysis of binary data. 2nd ed. London: Chapman & Hall, 1989.
16. Johnson DH, Zhu J, Schiller J, ct al. El 594 — a randomized phase III trial in metastatic non-small cell lung cancer (NSCLC) — outcome of PS 2 patients (Pts): an Eastern Cooperative Oncology Group Trial (ECOG). Prog Proc .Am Soc Clin Oncol 1999;18:461a. abstract.
17. Gandara DR, Crowley J, Livingston RB, et al. Evaluation of cisplatin intensity in metastatic non-small-cell lung cancer: a phase III study of the Southwest Oncology Group. J Clin Oncol 1993,11:873-8.
18 ckdeschel IC, Einkelstein DM, Ettinger DS, et al. A randomized trial of the four most active regimens for metastatic non-small-cell lung cancer. J Clin Oncol 1986,4:14-22.
19. Klastersky J, Sculier JP, Bureau G, et al. Cisplatin versus cisplatin plus etoposide in the treatment of advanced non-small-cell lung cancer. J Clin Oncol 1989,7:1087-92.
20. Bonomi PD, Finkelstein DM, Ruckdeschel JC, ct al. Combination chemotherapy versus single agents followed by combination chemotherapy in stage IV non-small-cell lung cancer: a study of the Eastern Cooperative Oncology Group. I Clin Oncol 1989;7:1602-13.
21. Ramsey SD, Moinpour CM, Lovato LC, Grevstad PK, Kelly K, Presant C. An economic analysis of Southwest Oncology Group Trial S9509: cisplatin/vinorelbine vs. carboplatin/paclitaxel for advanced non-small cell lung cancer. Prog Proc Am Soc Clin Oncol 2000;19:489a. abstract.Рис. 1. Стратификация и случайно назначаемые схемы лечения. AUC – площадь под кривой концентрация-время.

Рис. 2. Оценки по Каплану-Мейеру (A) для общей выживаемости и (B) времени до прогрессии заболевания среди исследованных больных в зависимости от назначенного лечения.
| Январь 2004 г. |