Опубликовано в журнале: Annals of Oncology, 13: 1539-1549 (2002)
Рандомизированное испытание фазы III по сравнению комбинации паклитаксел/карбоплатин с комбинацией паклитаксел/цисплатин у больных с распространенным немелкоклеточным раком легкого: кооперативное мультинациональное испытание
Р. Роселл, У. Гацемейер, Д.К. Беттикер, У. Кепплер, Х.Н. Мача, Р. Пиркер, П. Бертер, Ж.Л. Бри, П. Лианес, М. Николсон, А. Ардиззони, А. Чемаиссани, Ж. Богертс и Г. Галлант
История вопроса
Комбинации паклитаксела с цисплатином или карбоплатином обладают значительной активностью при немелкоклеточном раке легкого (НМРЛ).
Настоящее испытание по фазе III, проведенное на ранее нелеченых больных с НМРЛ, было предназначено для того, чтобы ответить на вопрос, будет ли процент ответа у больных, получающих комбинацию паклитаксел/карбоплатин, сходным с процентом у больных, получающих комбинацию паклитаксел/цисплатин. Паклитаксел применяли в дозе 200 мг/м2 (внутривенное вливание продолжительностью в 3 часа), после чего вводили карбоплатин при AUC равном 10 или цисплатин в дозе 80 мг/м2, лечение повторяли каждые 3 недели. Проводили сравнение выживаемости, токсичности и качества жизни.
Больные и методы.
Больных рандомизировали на получение одной из двух комбинаций, стратифицировали в зависимости от центра, функционального статуса, стадии заболевания и гистологии. Основной анализ процента ответа на лечение и выживаемости проводили на больных, в отношении которых было возможно проведение оценки ответа. Выживаемость анализировали, используя всех рандомизированных больных. Анализ токсичности проводили на всех леченых больных.
Результаты.
Всего было рандомизировано 618 больных. Две группы лечения были хорошо уравновешены по отношению к полу (83% мужчин), возрасту (медиана 58 лет), функциональному статусу (83% ECOG 0-1), стадии (68% IV, 32% 3B) и гистологии (38% плоскоклеточная карцинома). В группе паклитаксел/карбоплатин 306 больных получили всего 1311 курсов (медиана четыре курса, интервал 1-10 курсов), в группе паклитаксел/цисплатин 302 больных получили всего 1321 курс (медиана четыре курса, интервал 1-10 курсов). Карбоплатин вводили как было запланировано, при AUC равной 6, в 76% курсов, в то время как цисплатин вводили в запланированной дозе, равной 80 мг/м2 в 96% курсов. Процент ответа составлял 25% (70 из 279 больных) в группе паклитаксел/карбоплатин и 28% (80 из 284 больных) в группе паклитаксел/цисплатин (Р=0,45). Ответ оценивался независимым комитетом радиологов. Для всех рандомизированных больных медианное выживание составляло 8,5 месяцев для группы паклитаксел/карбоплатин и 9,8 месяцев для группы паклитаксел/цисплатин (отношение риска 1,20; 90%-ный доверительный интервал [ДИ] от 1,03 до 1,40); годичная выживаемость составляла 33% и 38%, соответственно. В отношении того же набора данных повторное рассмотрение выживаемости через 22 месяца дополнительных наблюдений дало медианную выживаемость, равную 8,2 месяца для группы паклитаксел/карбоплатин и 9,8 месяца для группы паклитаксел/цисплатин (отношение риска 1,22; 90%-ный ДИ от 1,06 до 1,40; Р=0,019); выживаемость за 2 года составляла 9% и 15%, соответственно. За исключением нейтропении и тромбоцитопении, которые были более частыми в группе паклитаксел/карбоплатин, и тошноты/рвоты и нефротоксичности, которые были более частыми в группе паклитаксел/цисплатин, процент тяжелых токсических эффектов обычно был низким и близким для двух групп. Общее качество жизни (использовалась анкета EORTC QLQC30 и модуль LC-13) также было близким для двух групп.
Выводы.
Это первое испытание по сравнению карбоплатина и цисплатина для лечения распространенного НМРЛ. Хотя комбинации паклитаксел/карбоплатин и паклитаксел/цисплатин дают близкий процент ответа, достоверно большая медианная выживаемость в группе паклитаксел/цисплатин показывает, что химиотерапия на основе цисплатина должна быть собой первым средством выбора при лечении.
Ключевые слова. Карбоплатин, цисплатин, двойные комбинации, немелкоклеточный рак легкого, паклитаксел.
ВВЕДЕНИЕ
Цисплатин продолжает оставаться основой химиотерапевтических комбинаций при немелкоклеточном раке легкого (НМРЛ), и при современном лечении этого заболевания используется несколько комбинированных схем химиотерапии на основе цисплатина. Хотя карбоплатин также широко используется, особенно в Соединенных Штатах в комбинации с паклитакселом, на сегодняшний день отсутствуют рандомизированные испытания по сравнению двух этих препаратов в аналогичных дозовых схемах. Предшествующее испытание [1], проведенное EORTC, в котором была использована комбинация VP16 с цисплатином (120 мг/м2) или карбоплатином (325 мг/м2), продемонстрировало несколько более высокую, но не достоверную разницу в ответе и выживаемости в комбинации с цисплатином; однако нарушение функции почек и миелотоксичность в группе цисплатина были значительно большими.
Имеются обширные данные о том, что цисплатин играет ключевую роль в лечении больных с НМРЛ [2]. Согласно мета-анализу, предпринятому Совместной группой по немелкоклеточному раку легкого, отношение риска составляло 0,73 (27%-ное снижение риска смерти и 10%-ное улучшение выживаемости на срок в 1 год), когда лечение цисплатином сравнивали с оптимальной поддерживающей терапией [3]. Последующее Британское исследование также смогло подтвердить положительные результаты химиотерапии на основе цисплатина [4]. Мета-анализ испытаний, выполненных в Северной Америке, показал, что только в пяти из 33 (15%) испытаний по фазе III обнаружено достоверное различие в выживаемости в пользу группы больных, получавших экспериментальную терапию. Четыре из этих пяти испытаний включали использование схем на основе цисплатина [5]. Винорелбин в виде монотерапии был первым препаратом, помимо цисплатина, который дал преимущество в плане выживания, которое (медиана) составляло 30 недель, по сравнению с 22 неделями для больных, получавших лечение фтороурацилом в комбинации с лейковорином [6].
Интересно, что паклитаксел в качестве индивидуального препарата давал медиану времени выживания, равную 6,8 месяцам по сравнению с 4,8 месяца для поддерживающей терапии. Медианное время до прогрессии составляло 3,9 месяца для больных в группе паклитаксела и 0,5 месяца для поддерживающей терапии. Модель регрессии по Коксу дала отношение риска, равное 0,68 в пользу паклитаксела. Не наблюдалось ответов у больных с плохим функциональным статусом, который чаще наблюдался у больных в возрасте ≥65 лет, по сравнению с более молодыми больными [7]. Другие исследования также выявили больший возраст в качестве прогностического фактора в отношении ответа на лечение и выживаемости [8-10]. Испытания по фазе II продемонстрировали активность паклитаксела в виде 24-часового внутривенного вливания как в виде монотерапии, так и в комбинации с карбоплатином [11-14].
Паклитаксел в виде 24-часового внутривенного вливания плюс цисплатин (75 мг/м2) сравнивали с цисплатином/этопозидом. Процент ответа для комбинации паклитаксел/цисплатин составлял около 26%, в то время как для комбинации цисплатин/этопозид он был равен 12,4% (Р<0,001). Медиана времени выживаемости составляла 9,9 месяцев по сравнению с 7,6 месяцев (Р=0,04) [15]. Однако проведенное EORTC испытание по сравнению комбинации цисплатин/тенипозид с комбинацией цисплатин/паклитаксел (175 мг/м2 в виде 3-часового внутривенного вливания) не обнаружило достоверных различий в отношении медианного времени выживания (9,9 и 9,7 месяца, соответственно), хотя процент ответа был выше в группе паклитаксела (28% по сравнению с 41%; Р=0,01 [16]. Цисплатин в форме монотерапии (100 мг/м2) сравнивался с комбинацией паклитаксел (175 мг/м2) плюс цисплатин (80 мг/м2). Хотя имели место различия в отношении процента ответа на лечение и выживания без прогрессии в пользу комбинации, медианная выживаемость в двух группах была сходной (8,6 месяцев для группы цисплатина и 8,1 месяца для группы паклитаксел/цисплатин) [2].
В других исследованиях анализировалось введение паклитаксела в форме 3-часового внутривенного вливания в комбинации с карбоплатином. Медианная выживаемость составляла 30 недель, однако она увеличилась до 39 недель, когда дозы паклитаксела превышали 175 мг/м2, дозы карбоплатина составляли 350-400 мг/м2 [17]. Паклитаксел (175 или 225 мг/м2) в форме 3-часового внутривенного вливания испытывали в комбинации с карбоплатином (AUC 6), при этом были обнаружены небольшие различия в пользу более высокой дозы паклитаксела с точки зрения процента ответа, выживаемости без прогрессии и медианной общей выживаемости [18]. Недавнее испытание, проведенное группой SWOG, подвело черту под достижениями химиотерапии. Комбинацию винорелбин/цисплатин (100 мг/м2) сравнивали с паклитакселом, применявшемся в форме 3-часового внутривенного вливания в комбинации с карбоплатином (AUC 6). Процент ответа составлял 28% и 25%, соответственно, а медианная выживаемость была одинаковой в обеих группах (8 месяцев). Однако миелотоксичность, а также тошнота и рвота наблюдались чаще в группе винорелбин/цисплатин [19]. Согласно опросу медиков-онкологов в Соединенных Штатах, комбинация паклитаксел/карбоплатин является наиболее принятой терапевтической комбинацией при лечении НМРЛ. Это можно объяснить практическими соображениями, поскольку введение является более легким, а токсичность меньшей по сравнению с комбинациями на основе цисплатина [20].
Настоящее крупномасштабное рандомизированное многоцентровое европейское испытание поставило вопрос о том, будет ли комбинация паклитаксел/карбоплатин давать такие же преимущества как и комбинация паклитаксел/цисплатин с точки зрения объективного процента ответа. Вторичными критериями были выживаемость, токсичность и качество жизни, причем проводился также анализ прогностических факторов, включая гистологию. Паклитаксел (200 мг/м2) применялся в обеих группах в виде 3-часового внутривенного вливания с цисплатином (80 мг/м2), или с карбоплатином (AUC 6).
БОЛЬНЫЕ И МЕТОДЫ
Больные
При отборе больных на участие в испытании использовались следующие критерии: (1) гистологический или цитологический диагноз НМРЛ; (2) стадия IIIB (злокачественые плевральные, перикардиальные выпоты и/или надключичная аденопатия) или стадия IV (больные с рецидивирующей стадией III или IV или повторное стадирование после хирургической операции); (3) возраст 18 лет или старше; (4) функциональный статус 0, 1 или 2 по шкале ECOG с ожидаемой продолжительностью жизни не менее 12 недель; (5) измеряемое (или неизмеряемое, но подвергающееся оценке) заболевание, причем по крайней мере один из очагов заболевания не должен был в прошлом подвергнут облучению; (6) отсутствие ранее проводившейся химиотерапии; (7) предыдущая лучевая терапия, если она проводилась, должна была быть завершена более чем за 3 недели до включения в испытание, и больной должен был восстановиться от побочных эффектов; (8) адекватная исходная функция костного мозга, документированная по абсолютному содержанию нейтрофилов, составляющему 1,5 х 109/л или более, содержание тромбоцитов 100 х 109/л или выше, гемоглобин 9 г/л или выше, общий билирубин сыворотки ≤1,25 х верхний предел нормы, трансаминазы печени <3- кратный верхний предел нормы и креатинин сыворотки ≤1,25 х верхний предел нормы.
Больные должны были быть в состоянии понять вопросник EORTC С30 по качеству жизни, который ранее был верифицирован для нескольких языковых и культурных групп в разных регионах Европы.
Больные не удовлетворяли критериям для участия в испытании, если у них наблюдалось одно из перечисленного ниже: (1) другое злокачественное заболевание в истории болезни или в настоящее время, за исключением подвергнутого куративному лечению рака кожи (не меланома) или карциномы шейки матки in situ или другой опухоли, со стороны которой не было признаков заболевания на протяжении пяти лет; (2) активная или неконтролируемая инфекция; (3) значительные нарушения сердечно- сосудистой системы (неконтролируемая гипертензия, нестабильная стенокардия, активная застойная сердечная недостаточность, инфаркт миокарда, перенесенный в предыдущем году, или неконтролируемая тяжелая аритмия); (4) беременность, лактация или отказ применять эффективные меры контрацепции; (5) симптоматические метастазы в мозг; (6) признаки периферической нейропатии; (7) неконтролируемый сахарный диабет; или (8) другие серьезные заболевания, которые могут нарушить способность больного получать лечение по протоколу, включая ранее наблюдавшиеся аллергические реакции в лекарственным препаратам, содержащим Cremophor EL.
Этические вопросы
Протокол исследования был утвержден комитетами по этике каждого из участвовавших в испытании медицинских учреждений. Перед началом испытаний у каждого больного после информирования было получено письменное согласие на участие. Больные были проинформированы о том, что хотя химиотерапия на основе цисплатина давала преимущества в плане выживаемости по сравнению с наилучшим поддерживающим уходом, было неизвестно, будет ли использование карбоплатина вместо цисплатина в комбинации с паклитакселом давать аналогичные преимущества или дополнительно улучшит результат.
Рандомизация и лечение
Рандомизация проводилась централизованно компанией Бристол-Майерс Сквибб, (Ватерлоо, Бельгия), с использованием динамического балансирующего алгоритма типа Покока-Саймона [21]. Эта процедура минимизирует дисбаланс в назначении на лечение по отношению к следующим параметрам: центр, функциональный статус (ECOG 0-1 или 2), стадия заболевания (IIIB или IV) и гистология (плоскоклеточная или неплоскоклеточная карцинома).
Паклитаксел, цисплатин и карбоплатин (Бристол-Майерс Сквибб Инк., Принстон, Нью- Джерси, США) были предоставлены бесплатно. Больные, рандомизированные в группу паклитаксел/цисплатин, получали паклитаксел в день 1 (200 мг/м2 в форме 3-часового внутривенного вливания) с последующим введением цисплатина (80 мг/м2 в виде 30- минутного внутривенного вливания). Больные, рандомизированные в группу паклитаксел/карбоплатин, получали паклитаксел в день 1 (200 мг/м2 в форме 3- часового внутривенного вливания) с последующим введением карбоплатина (до AUC 6 в форме 30-минутного внутривенного вливания). Дозу карбоплатина рассчитывали с использованием формулы Кальверта: доза мг=площадь под кривой (скорость гломерулярной фильтрации+25). Курсы лечения повторяли с интервалом в 21 день (Рис. 1). Паклитаксел разбавляли минимум в 500 мл 5%-ной глюкозы или нормального физраствора. Использовали фильтр из ацетата целлюлозы с диаметром пор 0,22 мкм, встроенный в систему для вливания. При использовании обеих схем лечение проводили с как и было запланировано, с интервалами 3 недели, или после восстановления от гематологических и негематологических токсических эффектов.
Наращивания дозы не проводилось, а снижение дозы основывалось на токсических эффектах в ходе предыдущего курса лечения. Ответ в обеих группах оценивали после каждых двух курсов в соответствии с критериями ВОЗ. Больных с прогрессирующим заболеванием снимали с химиотерапии. Больных со стабильным заболеванием лечили в течение максимум шести курсов или до прогрессии заболевания, появления неприемлемой токсичности препарата, которую нельзя было снять за счет модификации доз, или до тех пор, пока больные не отзывали свое согласие на участие.
Больных, давших полный ответ или частичный ответ, продолжали лечить в течение десяти курсов или до прогрессии заболевания.
Профилактика реакций на паклитаксел включала введение дексаметазона в дозе 20 мг перорально вечером перед химиотерапией и утром дня лечения, дифенгидрамина (димедрол) в дозе 50 мг внутривенно и циметидина в дозе 300 мг внутривенно (или 50 мг ранитидина) за 30 минут перед введением паклитаксела. Внутривенное введение дексаметазона (10 мг) плюс или ондасетрона (24-32 мг), или гранисетрона (10 мкг/кг) в сочетании с лоразепамом (1-2 мг) предлагалось в качестве составной части премедикации для профилактики рвоты. Пероральный дексаметазон использовался профилактически, если отмечались артралгии/миалгии степени II или более выраженные.
Оценка больных
Исходно оценивали следующие параметры: история болезни и физическое обследование; ЭКГ; содержание форменных элементов крови (гемоглобин, гранулоциты и тромбоциты); клиренс креатинина или клиренс ЭДТА; биохимия (креатинин сыворотки и билирубин); анализ на беременность для женщин в детородном возрасте; размеры опухоли. Делали рентгеновский снимок грудной клетки и проводили компьютерное сканирование (КТ-скан). Больных обследовали повторно, по крайней мере, один раз в 6 недель. Оценку опухоли проводили в соответствии с критериями ВОЗ (размеры опухоли; полный ответ; частичный ответ; стабильное заболевание; прогрессирующее заболевание). Опухоли подвергались повторной оценке в ходе лечения с использованием того же самого метода визуализации, который применялся для определения исходных размеров опухоли. Ранее облученные очаги исключались из оценки ответа опухоли на лечение. Качество жизни оценивалось с помощью верифицированного специфического для онкологии инструмента, который использовался больным исходно и по завершении каждого курса. Базовую анкету качества жизни EORTC (QLQ-C30) применяли вместе со специфическим модулем по оценке качества жизни при раке легкого (QLQ-LC13) [23]. Эти анкеты давали возможность измерить общее качество жизни, пять общих для онкологии функциональных аспектов (физическое, ролевое, когнитивное, эмоциональное и социальное функционирование) и 20 симптомов (чувство усталости, тошнота/рвота, боль, боли в области груди, боли в области плеча, боль в других локализациях, лечение боли, помощь в связи с лечением от боли, одышка, кашель, бессонница, рвота с кровью, боль во рту, дисфагия, запор, понос, периферическая нейропатия, алопеция, апетит и финансовые затруднения).
Статистический анализ
Главная цель настоящего испытания заключалась в том, чтобы продемонстрировать, что схема паклитаксел/карбоплатин не уступает по эффективности схеме паклитаксел/цисплатин. Запланированная численность группы испытания составляла 568 больных. В условиях применения схемы паклитаксел/цисплатин ожидаемый процент ответа составлял около -30%. Основным критерием в отношении процента ответа был критерий эквивалентности с нулевой гипотезой о том, что для комбинации паклитаксел/карбоплатин процент ответа будет, по крайней мере, на 10% хуже.
Соответственно, при использовании уровня достоверности, равного 5%, статистически достоверное доказательство отсутствия худшего результата было бы получено, если нижний предел двустороннего 90%-ного доверительного интервала (ДИ) для разницы в проценте ответа между схемами паклитаксел/цисплатин и паклитаксел/карбоплатин составлял –10% или более. Для получения 80%-ной уверенности в отношении этого критерия требовалось 520 больных, удовлетворяющих критериям для оценки ответа, при условии, что две схемы давали одинаковый истинный процент ответа, составляющий 30%.
Поскольку испытание было посвящено проверке эквивалентности, данные по всем больным, удовлетворяющим критериям в отношении ответа, были бы наиболее консервативными данными для первичного анализа [24]. Этот набор данных использовался для первичного анализа процента ответа, выживаемости и выживаемости без прогрессии. Запланированный тест эквивалентности в отношении выживаемости (а также выживаемости без прогрессии) должен был дать вывод об эквивалентности, если верхний доверительный интервал двустороннего 90%-го ДИ отношения риска (паклитаксел/цисплатин по отношению к паклитаксел/карбоплатин) составлял 1,27 или менее. Этот доверительный интервал был получен на основании регрессии по Коксу, стратифицированной по стадии опухоли, функциональному статусу и гистологии с учетом лечения как единственного фактора.
При проведении вторичного анализа все рандомизированные больные использовались для анализа выживаемости и выживаемости без прогрессии, что проводилось в строгом соответствии с принципом использования всего исходного числа больных.
Полученные доверительные интервалы трактовались в контексте критериев "не хуже", и "не лучше". Выживаемость без прогрессии измеряли, начиная с даты рандомизации до регистрации прогрессии или последнего обследования. При первом определении выживаемости без прогрессии больные, получавшие вторичную терапию перед документированной прогрессией заболевания, снимались с учета на момент проведения вторичной терапии. Согласно второму определению, больные, получавшие вторичную лучевую терапию или химиотерапию, считались имевшими соответствующее событие на этот момент.
Пропорциональная модель регрессии рисков по Коксу использовалась для определения выживаемости без прогрессии и общей выживаемости, стратифицированной по стадии опухоли, функциональному статусу и гистологии. Модель включала следующие прогностически важные переменные: потеря веса на протяжении последних 6 месяцев перед рандомизацией, пол, ранее проводившаяся лучевая терапия и исходный гемоглобин. Для каждой из этих переменных, таких как общая выживаемость и , выживаемость без признаков прогрессии (время до наступления события), рассчитывались оценки по Каплану-Мейеру на 1 год и 2 года для каждой группы лечения с соответствующими 95%-ными доверительными интервалами, а также медианные оценки с 95% ДИ.
Признаки и симптомы токсичности регистрировали в соответствии с тяжестью в таблицах частот. Токсичность оценивали с учетом наихудшего симптома для данного больного. Для каждого из токсических эффектов группы лечения сравнивали, используя точный критерий Фишера для таблиц 2х2 в отношении любого токсического эффекта, а также в отношении наличия тяжелой токсичности.
Влияние лечения на качество жизни во времени оценивали, используя кривые, показыающие медианные изменения во времени по отношению к исходному моменту в отношении глобальной шкалы, каждой из пяти функциональных шкал (физическая, ролевая, когнитивная, социальная и эмоциональная) и 20 шкал симптомов с использованием критерия стохастического группирования по Уей-Джонсону.
Окончательный анализ проводился с использованием базы данных, закрытой 2 ноября 1998 г. Кроме того, анализ обновленных данных по выживаемости был выполнен по обновленной базе данных, закрытой 11 сентября 2001 г.
РЕЗУЛЬТАТЫ
Характеристики больных
В период с апреля 1996 по июль 1997 г.г. в 42 центрах, находящихся в 16 странах, было рандомизировано 618 больных. Характеристики всех рандомизированных на испытание больных приведены в Таблице 1. Характеристики больных на исходный момент были хорошо сбалансированы между двумя группами лечения. Сто семь больных – 53 (17%) в группе паклитаксел/карбоплатин и 54 больных (17%) в группе паклитаксел/цисплатин – имели функциональный статус по ECOG равный 2. Среди 618 рандомизированных больных диагноз НМРЛ был подтвержден гистологически у 616 (Таблица 2). У одного больного (в группе паклитаксел/цисплатин) была гистиоцитома и у одного больного (в группе паклитаксел/цисплатин) исходно предполагалась плоскоклеточная карцинома легкого, однако позже диагноз был изменен на плоскоклеточную карциному гортани. Гистология и стадии опухоли были одинаково распределены между двумя группами лечения. 369 больных (60%) имели стадию IV заболеваниz, у 49 (8%) больных заболевание было локальным или метастатическим, а 198 больных (32%) имели стадию IIIB. У двух больных в группе паклитаксел/цисплатин исходно стадия была классифицирована как IIIA. Шестьдесят один больной (10%) ранее получал лучевую терапию.
Таблица 1. Характеристики больных (все рандомизированные больные)
Паклитаксел/
цисплатин
(n=309)Паклитаксел/
карбоплатин
(n=309)Всего (n=608)
Пол [n (%)]
Мужчины 253 (82)
258 (83)
511 (83)
Женщины 56 (18)
51 (17)
107 (17)
Возраст, годы
Медиана 58
58
58
Интервал 29-78
27-76
27-78
<65 лет [n (%)] 222 (72)
218 (71)
440 (71)
≥65 лет [n (%)] 87 (28)
91 (29)
178 (29)
Потеря веса [n (%)]
<5% 151 (49)
159 (51)
310 (50)
5-10% 62 (20)
53 (17)
115 (19)
>10% 47 (15)
50 (16)
97 (16)
Не сообщается 49 (16)
47 (15)
96 (16)
Функциональный статус по ECOG [n (%)]
0 50 (16)
52 (17)
102 (17)
1 205 (66)
204 (66)
409 (66)
2 53 (17)
53 (17)
106 (17)
3 1 (<1)
-
1 (<1)
Гистология [n (%)]
Аденокарцинома 139 (45)
145 (47)
284 (46)
Плоскоклеточная карцинома 117 (38)
115 (37)
232 (38)
Крупноклеточная карцинома 29 (9)
31 (10)
60 (10)
Прочее 24 (8)
18 (6)
42 (7)
Стадия опухоли
IIIA 2 (1)
0 (0)
2 (<1)
IIIB 108 (35)
90 (29)
198 (32)
IV 178 (58)
191 (62)
369 (60)
Местный рецидив 8 (3)
9 (3)
17 (3)
Метастатический рецидив 13 (4)
19 (6)
32 (5)
Предшествующая лучевая терапия [n (%)]
Да 28 (9)
33 (11)
61 (10)
Нет 281 (91)
276 (89)
557 (90)
Опухоль может быть измерена [n (%)]
В двух направлениях 288 (93)
285 (92)
573 (93)
В одном направлении 4 (1)
1 (<1)
5 (1)
Пригодна для оценки 17 (6)
23 (7)
40 (6)
Таблица 2. Число пролеченых больных на каждый курс (все леченые больные)
Номер курса [n (%)]
Паклитаксел/
цисплатин
(n=302)Паклитаксел/
карбоплатин
(n=306)1
302 (100)
306(100)
2
275 (91)
279 (91)
3
226 (75)
220 (72)
4
194 (64)
187 (61)
5
143 (47)
139 (45)
6
118 (39)
123 (40)
7
29 (10)
26 (8)
8
22 (7)
22 (7)
9
9 (3)
6 (2)
10
3 (1)
3 (1)
Всего курсов
1321
1311
Медианное число курсов
4
4
Интервал
1-10
1-10
Таблица 3. Процент ответа у больных, удовлетворяющих критериям для оценки ответа при наличии измеримой опухоли
Паклитаксел/
цисплатин
(n=284) [n (%)]Паклитаксел/
карбоплатин
(n=279) [n (%)]Полный ответ
2 (1)
4 (1)
Частичный ответ
78 (27)
66 (24)
Стабильное заболевание
123 (43)
112 (40)
Прогрессия заболевания
58 (20)
80 (29)
Ранний летальный исход,
токсичность23 (8)
17 (6)
Таблица 4. Последующее лечение (все рандомизированные больные)
Паклитаксел/
цисплатин
[n (%)]Паклитаксел/
карбоплатин
[n (%)]Число больных с последующим лечением
185 (60)
183 (59)
Лучевая терапия*
139 (45)
131 (42)
Химиотерапия*
72 (23)
74 (24)
Одна схема
58
67
Две схемы
10
6
Три схемы
4
0
Четыре схемы
0
1
Прочие виды лечения**
31 (10)
26 (8)
*Больным могла проводиться последующая терапия более чем одного типа
**Включает хирургию, гормонотерапию, лечение кортикостероидами и формы лечения, не подтвержденные медицинскими соображениями.Таблица 5. Химиотерапия второй линии
Паклитаксел/
цисплатин
(n=72)Паклитаксел/
карбоплатин
(n=74)Гемцитабин
32
33
Винорелбин
28
29
Цисплатин
12
15
Этопозид
13
7
Митомицин С
7
4
Циклофосфамид
4
6
5-Фтороурацил
5
5
Циклофосфамид
7
2
Карбоплатин
7
3
Метотрексат
1
4
Доксорубицин
1
3
Виндезин
1
3
Доцетаксел
1
2
Винбластин
0
3
Паклитаксел
4
1
Ломустин
0
3
Прочие препараты
5
6
Больные могли получать несколько препаратов Две исследованные группы были хорошо сбалансированы в отношении измеримости опухоли. Исходно у 573 (93%) больных опухоль можно было измерить в двух направлениях, в то время как у пяти больных (1%) опухоль можно было измерить в одном направлении, а у 40 больных (6%) заболевание не поддавалось измерению.
Проведение химиотерапии
Из 618 рандомизированных больных 10 (2%) не получили исследуемого препарата. У 306 больных было проведено 1311 курсов паклитаксела/карбоплатина, а у 302 больным было проведено лечение 1321 курсом паклитаксела/цисплатина (Таблица 2).
Медианное число курсов составляло четыре курса (интервал 1-10) в обеих группах лечения. Двадцать шесть (8%) больных в группе паклитаксел/карбоплатин получили более шести курсов лечения по сравнению с 29 (10%) в группе паклитаксел/цисплатин.
У 156 (51%) больных, получавших комбинацией паклитаксел/карбоплатин, и у 75 (25%) больных, получавших схему паклитаксел/цисплатин, потребовалось снижение дозы. В группе паклитаксел/карбоплатин у 71 больного была доза концентрация паклитаксела и у 144 больных доза карбоплатина, в то время как в группе паклитаксел/цисплатин у 47 больных была снижена доза паклитаксела, а у 65 больных доза цисплатина. Медианная кумулятивная доза паклитаксела, полученная больными, была сходной в обеих группах: 799мг/м2 в группе паклитаксел/карбоплатин и 807 мг/м2 в группе паклитаксел/цисплатин. Медианная интенсивность дозы паклитаксела в обеих группах составляла 65 мг/м2/неделю, что весьма близко к запланированной интенсивности дозы, равной 66,7 мг/м2/неделю. ПО существу, более 80% больных в данном испытании получили более 90% запланированной интенсивности дозы паклитаксела. Медианная интенсивность дозы препаратов платины в обеих группах была также близкой к запланированной. В группе паклитаксел/карбоплатин медианная интенсивность дозы карбоплатина составляла 1,9 мг/мл х мин/неделю по сравнению с запланированной равной 2 мг/мл х мин/неделю. В группе паклитаксел/цисплатин медианная интенсивность дозы цисплатина составляла 26 мг/м2/неделю, что весьма близко к запланированной величине, равной 26,7 мг/м2/неделю.
Процент ответа, выживаемость без прогрессии и общая выживаемость
Среди 618 рандомизированных больных, 279 в группе паклитаксел/карбоплатин и 284 в группе паклитаксел/цисплатин имели измеримое заболевание, удовлетворяющее критериям для определения ответа (Таблица 3). В этом первичном массиве общий клинический ответ составлял 25% (95%-ный ДИ от 20 до 31%) для группы паклитаксел/карбоплатин и 28% (95%-ный ДИ от 23 до 34%) в группе паклитаксел/цисплатин. В группе паклитаксел/карбоплатин наблюдалось четыре случая полного ответа, а в группе паклитаксел/цисплатин было два таких случая.
Двусторонний 90%-ный ДИ для различия в проценте ответа находился в интервале от – 10% до 3,4%, указывая, что комбинация паклитаксел/карбоплатин статистически не уступает комбинации паклитаксел/цисплатин. Классический тест на превосходство для сравнения процента ответа между двумя группами дал значение Р равное 0,45. Когда были учтены все рандомизированные больные (исходное число больных), проценты ответа составляли 23% (70 из 309 больных) в группе паклитаксел/карбоплатин и 26% (80 из 309 больных) в группе паклитаксел/цисплатин. На момент исходного анализа 95% больных в группе паклитаксел/карбоплатин и 93% больных в группе паклитаксел/цисплатин имели признаки прогрессии опухоли или получили вторичное лечение перед документацией прогрессии опухоли. Среди общего числа больных медианная выживаемость без прогрессии составляла 3 месяца (95%-ный ДИ от 2,7 до 3,9 месяца) для группы паклитаксел/карбоплатин и 4,2 месяца (95%-ный ДИ от 3,3 до 4,4 месяца) для группы паклитаксел/цисплатин (Р=0,035 на основании лог-рангового критерия).
Если начало вторичной терапии считать регистрируемым событием для всех включенных в испытание больных, то медианная выживаемость без прогрессии составляла 2,9 месяца (95%-ный ДИ от 2,7 до 3,5 месяца) для группы паклитаксел/карбоплатин и 3,3 месяца (95%-ный ДИ от 3 до 4 месяцев) для группы паклитаксел/цисплатин (Р=0,36 на основании лог-рангового критерия) (Рис. 2).
По крайней мере одну из форм вторичного лечения получили более половины больных: 183 из 309 (59%) больных в группе паклитаксел/карбоплатин и 185 из 309 (60%) больных в группе паклитаксел/цисплатин (Таблица 4). Наиболее частой формой вторичного лечения была лучевая терапия. В целом, 44% больных получили лучевую терапию по завершении испытания. Химиотерапия использовалась приблизительно у четверти больных. Двадцать четыре процента больных из группы паклитаксел/карбоплатин и 23% больных из группы паклитаксел/цисплатин получали по крайней мере одну схему вторичной терапии. Наиболее часто использовавшимися химиотерапевтическими препаратами второй линии были гемцитабин, винорелбин, цисплатин, этопозид и митомицин С (Таблица 5). В целом, паклитаксел вводился повторно только пяти больным. Примечательно, что больше больных в группе паклитаксел/цисплатин по сравнению с группой паклитаксел/карбоплатин получали химиотерапию последнего выбора и/или лучевую терапию перед прогрессией заболевания. На момент проведения анализа умерло 479 больных (81% в группе паклитаксел/карбоплатин и 74% больных в групеп паклитаксел/цисплатин). По отношению к исходному числу больных медианная выживаемость составила 8,5 месяца (95%-ный ДИ от 7,4 до 9,6 месяца) в группе паклитаксел/карбоплатин и 9,8 месяца (95%-ный ДИ от 8,3 до 11 месяцев) в группе паклитаксел/цисплатин. Оценки процента выживаемости по Каплану-Мейеру на срок в один год составляли 33% (95%- ный ДИ от 27% до 38%) в группе паклитаксел/карбоплатин и 38% (95%-ный ДИ от 33% до 44%) в группе паклитаксел/цисплатин.
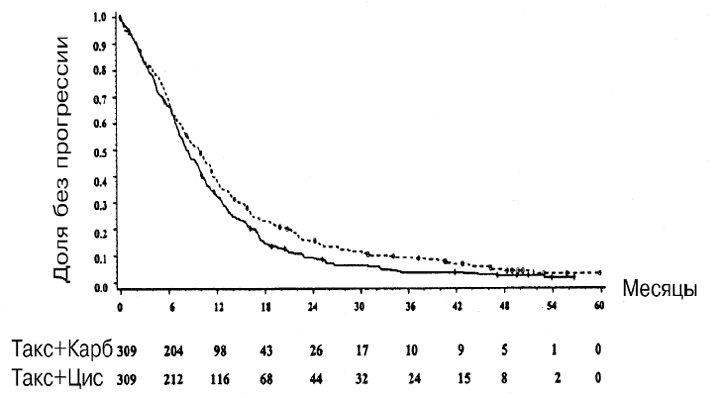
На момент обновления данных по выживаемости (сентябрь 2001 г.) умерло 579 больных (95% в группе паклитаксел/карбоплатин и 92% больных в группе паклитаксел/цисплатин). С учетом исходного числа больных медианная выживаемость составила 8,2 месяца (95%-ный ДИ от 7,4 до 9,6 месяцев) в группе паклитаксел/карбоплатин и 9,8 месяца (95%-ный ДИ от 8,2 до 11 месяцев) в группе паклитаксел/цисплатин (Р=0,019 на основании лог-рангового критерия) (Рис. 3).
Стратифицированное отношение риска между группами лечения составило 1,22 (90%- ный ДИ от 1,06 до 1,40).
Токсичность
Все 608 больных, получивших по крайней мере одну дозу терапии, были использованы для анализа токсичности. Это включало 306 больных в группе паклитаксел/карбоплатин и 302 больных в группе паклитаксел/цисплатин.
Гематологические и негематологические токсические эффекты приведены в Таблицах 6 и 7, соответственно. Комбинация паклитаксел/карбоплатин вызывала более тяжелую лейкопению (степень 3 и 4) и более тяжелую тромбоцитопению по сравнению с комбинацией паклитаксел/цисплатин (Таблица 6). Тяжелая нейтропения и тяжелая анемия наблюдались в одинаковом проценте в двух группах лечения.
Нейтропеническая лихорадка наблюдалась у 6% больных в группе паклитаксел/карбоплатин и у 4% больных в группе паклитаксел/цисплатин (Р=0,189).
Тяжелые инфекции были редкими: они отмечались у 15 больных (5%) в группе паклитаксел/карбоплатин и у 14 больных (5%) в группе паклитаксел/цисплатин (Р=1,000). Комбинация паклитаксел/цисплатин давала больше случаев тошноты/рвоты, поноса и почечной токсичности по сравнению с комбинацией паклитаксел/карбоплатин (Таблица 7). В двух группах не наблюдалось различий в отношении частоты или тяжести периферической нейропатии и миалгии/артралгии. Реакции гиперчувствительности развились у семи больных (2%) в группе паклитаксел/карбоплатин и у 10 больных (3%) в группе паклитаксел/цисплатин. Всего у трех больных, причем все из них в группе паклитаксел/цисплатин, развились тяжелые реакции гиперчувствительности. Периферическая нейропатия, в основном степени 1 или 2, наблюдалась у 59% больных в группе паклитаксел/карбоплатин и у 58% больных в группе паклитаксел/цисплатин. Тяжелые симптомы (степень 3) наблюдались у 9% больных в группе паклитаксел/карбоплатин и у 7% больных в группе паклитаксел/цисплатин. Артралгия/миалгия отмечалась у 62% больных в группе паклитаксел/карбоплатин и у 57% больных в группе паклитаксел/цисплатин. Эти симптомы обычно носили легкий или умеренный характер, а частота тяжелых эпизодов составляла около 10% для обеих групп. Большее число больных в группе паклитаксел/цисплатин (38%) по сравнению с группой паклитаксел/карбоплатин (15%) давали почечную токсичность. Тяжелые эпизоды отмечались у трех больных в группе паклитаксел/карбоплатин и у четырех больных в группе паклитаксел/цисплатин.
Таблица 6. Гематологическая токсичность (все леченые больные)
Паклитаксел/
цисплатин
(n=302) (%)Паклитаксел/
карбоплатин
(n=306) (%)Лейкопения
Любая 73
74
Тяжелая (степени III-IV) 16*
23
Нейтропения
Любая 73
70
Тяжелая (степени III-IV) 51
54
Тромбоцитопения
Любая 13*
27
Тяжелая (степени III-IV) 2*
8
Анемия
Любая 95
94
Тяжелая (степени III-IV) 9
7
Фебрильная нейтропения
4
6
Инфекция
Любая 16
20
Тяжелая (степени III-IV) 5
5
*P<0,05
Анализ качества жизни
Анализ качества жизни проводился на большом числе больных и для одинакового процента больных в обеих группах. Исходно 258 (84%) больных в группе паклитаксел/карбоплатин и 256 больных (85%) в группе паклитаксел/цисплатин заполнили анкеты по качеству жизни. До 120-го дня соблюдение этих требований было отличным, причем две трети больных, потенциально удовлетворяющих критериям для оценки качества жизни, практически принимали в этом участие. Начиная со 120-го дня, число больных снизилось до менее, чем 50% по отношению ко всем потенциальным больным. Сравнивая изменения по отношению к исходному моменту для всех периодов испытания (Таблица 8), мы обнаружили достоверные различия между группами лечения. Потеря аппетита была более тяжелой в группе паклитаксел/цисплатин (Р=0,084); гемоптизис (рвота с кровью) отмечался чаще в группе паклитаксел/карбоплатин (Р=0,048). Болевые симптомы и боли в области груди также чаще отмечались в группе паклитаксел/карбоплатин (Р=0,058 и 0,046, соответственно); использование лекарственных препаратов для снятия болей было более высоким в группе паклитаксел/карбоплатин (Р=0,054). Примечательно, что в двух группах не отмечалось достоверных различий в отношении общего статуса здоровья или в отношении функциональных шкал, которые представляют собой глобальные индексы качества жизни.
Таблица 7. Негематологическая токсичность (все леченые больные)
Паклитаксел/
цисплатин
(n=302) (%)Паклитаксел/
карбоплатин
(n=306) (%)Реакции гиперчувствительности
Любая 31
2
Тяжелая 1
0
Периферическая нейропатия
Любая 58
59
Тяжелая 7
9
Артралгия/миалгия
Любая 57
62
Тяжелая 9
8
Астения
Любая 43
42
Тяжелая 10
10
Ототоксичность
Любая 4
3
Тяжелая 0
<1
Тошнота/рвота
Любая 70*
49
Тяжелая 14*
6
Диарея
Любая 19*
15
Тяжелая 2
1
Почечная токсичность
Любая 38*
15
Тяжелая 1
1
*P<0,05
Таблица 8. Результаты по EORTC QLQ-C30/LC-13: сравнение различий по сравнению с исходным моментом во времени (все леченые больные)
Значение Р* в пользу:
Паклитаксел/
цисплатинНи тот, ни другой
Паклитаксел/
карбоплатинФункциональные шкалы
Физическое функционирование
0,419
Ролевое функционирование
0,622
Эмоциональное функционирование
0,466
Когнитивное функционирование
0,588
Социальное функционирование
0,384
Глобальный статус здоровья
0,939
Шкалы симптомов
Тошнота и рвота
0,149
Затрудненное глотание
0,866
Боли в рту
0,995
Запор
0,468
Понос
0,252
Потеря аппетита
0,084
Чувство усталости
0,955
Бессоница
0,985
Потеря волос
0,540
Периферическая нейропатия
0,792
Финансовые затруднения
0,313
Одышка
0,163
Кашель
0,107
Гемоптиз
0,048
Боли
0,058
Боли в области груди
0,046
Боли в области плеча
0,493
Боли в других местах
0,488
Лекарственные препараты для обезболивания
0,054
Лекарственные препараты помогают
0,606
*Стохастический тест Уэй-Джонсона.
ОБСУЖДЕНИЕ
Между 1984 и 1985 г.г. ECOG провела крупномасштабное рандомизированное испытание в пяти группах на 743 больных метастатическим немелкоклеточным раком легкого, в котором сравнивались ипроплатин и карбоплатин с последующим использованием схемы MVP (митомицин, винбластин и цисплатин) на момент прогрессии; использовались также двойные комбинации (винбластин+цисплатин) и триплеты MVP и MVP попеременно с CAMP (циклофосфамид, доксорубицин, метотрексат и прокарбазин). Карбоплатин выделялся как препарат, дающий достоверно более длительное выживание без признаков прогрессии (29 недель, Р=0,01) и более длительную медианную выживаемость (31,7 недели). Общая медианная выживаемость для всех больных составляла 25,4 недели [25]. Карбоплатин также давал лучшее выживание и при других опухолях. Например, в исследовании 1526 больных раком яичников не обнаружилось различий в выживаемости между больными, получавшими схему САР (циклофосфамид, доксорубицин и цисплатин), и больными, получавшими карбоплатин в форме монотерапии [26].
Здесь мы описываем первое крупномасштабное рандомизированное испытание по прямому сравнению комбинации паклитаксел/карбоплатин с комбинацией паклитаксел/цисплатин при лечении распространенного НМРЛ. Достоверно лучшая выживаемость, при применении цисплатина, отличается от результата, о котором сообщалось в аналогичных испытаниях, проводившихся в США. В недавнем испытании ECOG с четырьмя группами [27], где 1207 больных были рандомизированы на получение паклитаксела (в виде 24-часового внутривенного вливания) в комбинации с цисплатином, комбинации гемцитабин/цисплатин, комбинации доцетаксел/цисплатин или комбинации паклитаксел (в виде 3-часового внутривенного вливания)/карбоплатин, процент ответа для всех 1155 больных, удовлетворяющих критериям для оценки, составлял 19%, медианная выживаемость равнялась 7,9 месяца, а процент больных выживающих в течение года, составлял 33% (11% за 2 года).
Процент ответа и выживаемость достоверно не отличались для больных, получавших паклитаксел/цисплатин, и больных, находившихся в любой из прочих трех групп [27].
С другой стороны, в недавнем крупномасштабном международном рандомизированном испытании по сравнению комбинаций доцетаксел/карбоплатин, доцетаксел/цисплатин и винорелбин/цисплатин было сообщено о достоверно лучшей медианной выживаемости в группе доцетаксел/цисплатин (10,9 месяцев) [28], а Европейское рандомизированное испытание также сообщило о медианной выживаемости, равной 10 месяцам, в группе доцетаксел/цисплатин [29].
Различия между паклитакселом/цисплатином и паклитакселом/карбоплатином, обнаруженные в настоящем испытании, не обусловлены неоднородным распределением больных по характеристикам (Таблица 1) или числом полученных курсов лечения (Таблица 2). Единственное искажение заключалось в том, что для 96 из 279 больных, удовлетворяющих критериям, потребовалось снижение дозы карбоплатина; это снижение произошло в основном на курсе 1 из-за неправильного расчета AUC. Средний AUC для этих 96 больных составлял 4,9.
Тот факт, что в исследовании ECOG [27] не были обнаружены различия между комбинациями паклитаксел/карбоплатин и паклитаксел/цисплатин, приводит нас к выводу, что мы должны относиться к результатам настоящего испытания с осторожностью. Мы можем постулировать, что непрерывное вливание паклитаксела может модифицировать терапевтическую эффективность комбинации. В предшествующем испытании ECOG [15] медианная выживаемость для группы паклитаксел/цисплатин, где паклитаксел вводился путем непрерывного вливания, составляла 9,9 месяца по сравнению с 7,6 месяца для группы цисплатин/этопозид.
Рекомендованная доза паклитаксела для дальнейших исследований составляла 135 мг/м2 путем 24-часового непрерывного вливания плюс цисплатин. В исследовании Schiller с соавт. [27] контрольная группа получала эту комбинацию, однако не было отмечено никаких различий по сравнению с паклитакселом, вводимым в дозе 225 мг/м2 путем 3-часового вливания, в комбинации с карбоплатином до AUC 6. Цитируемое испытание несколько отличается от настоящего испытания, где больные получали паклитаксел в дозе 200 мг/м2 путем 3-часового вливания плюс карбоплатин до AUC 6.
Это следует принять во внимание в будущих исследованиях и при проведении мета- анализов.
Крупномасштабное европейское рандомизированное испытание может внести большой вклад в разрешение длительно ведущихся дебатов о превосходстве химиотерапии на схемах, основанных на карбоплатине или цисплатине при раке легкого. С учетом более длительного медианного выживания, достигнутого на комбинации паклитаксел/цисплатин, использование этой комбинации может быть рекомендовано при лечении больных с распространенным и метастатическим НМРЛ. Комбинация паклитаксел/карбоплатин является разумной альтернативой, дающей аналогичный процент ответа, хороший профиль безопасности, приемлемую токсичность и чрезвычайную легкость применения.
Литература
1. Klastersky J, Sculler JP, Lacroix H et al. A randomized study comparing cisplatin or carboplatin with etoposide in patients with advanced non-small-cell lung cancer: European Organization for research and treatment of cancer protocol 07861. J Clin Oncol 1990; 8:1556-1562.
2. Gatzemeier U, von Pawel J, Gottfried M et al. Phase III comparative study of high-dose cisplatin versus a combination of paclitaxel and cisplatin in patients with advanced nonsmall- cell lung cancer. J Clin Oncol 2000;18:3390-3399.
3. Non-Small Cell Lung Cancer Collaborative Group. Chemotherapy in non-small cell lung cancer: a meta-analysis using updated data on individual patients from 52 randomised clinical trials. Br Med J 1995; 311:899-909.
4. Cullen MB, Billingham LJ, Woodroffe CM et al. Mitomycin, ifosfamide, and cisplatin in unresectable non-small-cell lung cancer: effects on survival and quality of life. J Clin Oncol 1999; 17: 3188-3194.
5. Breathnach OS, Freidlin В, Conley В et al. Twenty-two years of phase III trials for patients with advanced non-small-cell lung cancer: sobering results. J Clin Oncol 2001; 19: 1734- 1742.
6. Crawford J, O'Rourke M, Schiller JH et al. Randomized trial of vinorelbine compared with fluorouracil plus leucovorin in patients with stage IV non-small-cell lung cancer. J Clin Oncol 1996; 14: 2774-2784.
7. Ranson M, Davidson N, Nicolson M et al. Randomized trial of paclitaxel plus supportive care versus supportive care for patients with advanced non-small-cell lung cancer. J Natl Cancer Inst 2000; 92:1074-1080.
8. Albain KS, Crowley JJ, LeBlanc M, Livingston RB. Survival determinants in extensivestage non-small-cell lung cancer: the Southwest Oncology Group experience. J Clin Oncol 1991; 9: 1618-1626.
9. Paesmans M, Sculier JP, Libert P et al. Prognostic factors for survival in advanced nonsmall- cell lung cancer: univariate and multivariate analyses including recursive partitioning and amalgamation algorithms in 1,052 patients. J Clin Oncol 1995; 13: 1221-1230.
10. Hickish TF, Smith IE, Ashley S, Middleton G. Chemotherapy for elderly patients with lung cancer. Lancet 1995; 346: 580.
11. Murphy WK, Fossella FV, Win RJ et al. Phase II study of Taxol in patients with untreated advanced non-small-cell lung cancer. J Natl Cancer Inst 1993; 85: 384-388.
12. Chang AY, Kim К, Click J et al. Phase II study of Taxol, merbarone, and piroxantrone in stage IV non-small-cell lung cancer: the Eastern Cooperative Oncology Group results. J Natl Cancer Inst 1993; 85:388-394.
13. Johnson DH, Paul DM, Hande KR et al. Paclitaxel plus carboplatin in advanced nonsmall- cell lung cancer: a phase II trial. J Clin Oncol 1996;14:2054-2060.
14. Langer CJ, Leighton JC, Comis RL et al. Paclitaxel and carboplatin in combination in the treatment of advanced non-small-cell lung cancer: a phase II toxicity, response, and survival analysis. J Clin Oncol 1995;13:1860-1870.
15. Bonomi P, Kim KM, Fairclough D et al. Comparison of survival and quality of life in advanced non-small-cell lung cancer patients treated with two dose levels of paclitaxel combined with cisplatin versus etoposide with cisplatin: results of an Eastern Cooperative Oncology Group trial. J Clin Oncol 2000; 18: 623-631.
16. Giaccone G, Splinter TAW, Debruyne Ch et al. Randomized study of paclitaxel-cisplatin versus cisplatin-teniposide in patients with advanced non-small-cell lung cancer. J Clin Oncol 1998; 16: 2133-2141.
17. Kelly К, Pan Z, Murphy J et al. A phase I trial of paclitaxel plus carboplatin in untreated patients with advanced non-small cell lung cancer. Clin Cancer Res 1997; 3: 1117-1123.
18. Kosmidis P, Mylonakis N, Skarlos D et al. Paclitaxel (175 mg/m2) plus carboplatin (6 AUC) versus paclitaxel (225 mg/m2) plus carboplatin (6 AUC) in advanced non-small-cell lung cancer (NSCLC): a multicenter randomized trial. Ann Oncol 2000; 11: 799-805.
19. Kelly К, Crowley J, Bunn PA et al. A randomized phase III trial of paclitaxel plus carboplatin versus vinorelbine plus cisplatin in the treatment of patients with advanced nonsmall cell lung cancer: a Southwest Oncology Group trial. J Clin Oncol 2001; 19: 3210- 3218.
20. Shyr Y, Choy H, Cmelak A et al. Pattern of practice survey: non-small cell lung cancer in the U.S. Proc Am Soc Clin Oncol 1998; 17: 463a (Abstr l778).
21. Pocock S, Simon R. Sequential treatment assignment with balancing for prognostic factors in the controlled clinical trial. Biometrics 1975; 31:103-115.
22. Aaronson NK, Ahmedzai S, Bergman В et al. The European organization for research and treatment of cancer QLQ-C30: a quality-of-life instrument for use in international clinical trials in oncology. J Natl Cancer Inst 1993; 85: 365-376.
23. Bergman В, Aaronson NK, Ahmedzai S et al. The EORTC QLQ-LC 13: a modular supplement to the EORTC core quality of life questionnaire (QLQ-C30) for use in lung cancer clinical trials. Eur J Cancer 1994; 30A: 635-642.
24. ICH E9 Guideline: Statistical Principles for Clinical Trials, EU: CPMP/ICH/363/96, FDA: Federal Register, Vol. 63, No. 179, September 16, 1998, p. 49583.
25. Bonomi PD, Finkelstein DM, Ruckdeschel JC et al. Combination chemotherapy versus single agents followed by combination chemotherapy in stage IV non-small-cell lung cancer: a study of the Eastern Cooperative Oncology Group. J Clin Oncol 1989; 7: 1602- 1613.
26. The ICON Collaborators. ICON2: randomised trial of single-agent carboplatin against three-drug combination of CAP (cyclophosphamide, doxorubicin, and cisplatin) in women with ovarian cancer. Lancet 1998; 352:1571-1576.
27. Schiller JH, Harrington D, Belani CP et al. Comparison of four chemotherapy regimens for advanced non-small-cell lung cancer. N Engl J Med 2002; 346: 92-98.
28. Rodriguez J, Pawel A, Pluzanska A et al. A multicenter, randomized phase III study ofdocetaxel + cisplatin (DC) and docetaxel + carboplatin (DCB) vs vinorelbine + cisplatin (VC) in chemotherapy-naive patients with advanced and metastatic non-small cell lung cancer. Proc Am Soc Clin Oncol 2001; 20: 314a (Abstr 1252).
29. Georgoulias V, Papadakis E, Alexopoulos A et al. Platinum-based and non-platinumbased chemotherapy in advanced non-small-cell lung cancer: a randomised multicentre trial. Lancet 2001; 357: 1478-1484.Рис. 1. Диаграмма распределения больных и схемы лечения
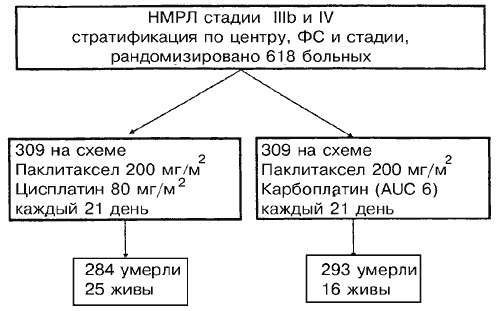
Рис. 2. Кривые по Каплану-Мейеру, иллюстрирующие время до прогрессии опухоли, у больных, получавших лечение комбинацией паклитаксел/цисплатин и комбинацией паклитаксел/карбоплатин (данные по всем больным)
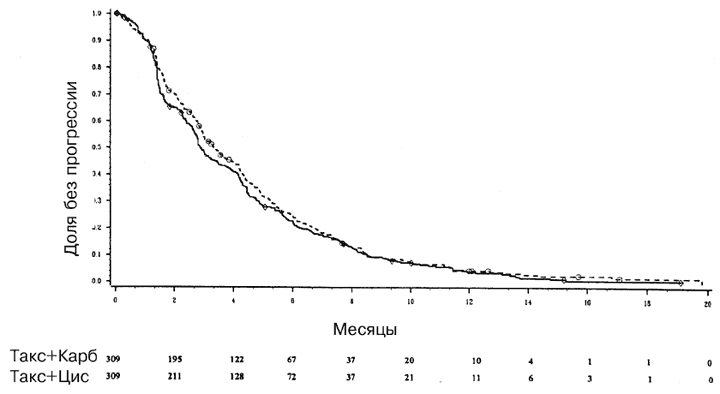
Рис. 3. Кривые по Каплану-Мейеру, иллюстрирующие выживаемость больных, получавших лечение комбинацией паклитаксел/цисплатин и комбинацией паклитаксел/карбоплатин (данные по всем больным); обновление данных по выживанию сентябрь 2001 г.
| Январь 2004 г. |