Опубликовано в журнале: Journal of Clinical Oncology, 20: 3578-3585 (2002)
Комбинация паклитаксел/карбоплатин по сравнению с комбинацией гемцитабин/паклитаксел при распространенном немелкоклеточном раке легкого: рандомизированное испытание по фазе III
П. Космидис, Н. Миланакис, К. Николаидес, К. Калофонос, Э. Саманас, Дж. Буковинас, Дж. Фоунтцилас, Д. Скарлос, Т. Экономопулос, Д. Царваридис, П. Папакостас, К. Баконионис и М. Димопулос от Греческой кооперативной группы по онкологии (HeCOG)
Цель исследования.
Мы провели настоящее рандомизированное испытание по сравнению активности и токсичности комбинации паклитаксел/гемцитабин (ПГ) и комбинации паклитаксел/карбоплатин (ПК) для лечения распространенного немелкоклеточного рака легкого (НМРЛ).
Больные и методы.
Ранее не получавшие химиотерапии больные были рандомизированы на введение паклитаксела в дозе 200 мг/м2 в первый день, плюс карбоплатин до значения AUC 6 в первый день (группа А), или на паклитаксел, как указано выше, плюс гемцитабин (1000 мг/м2 в дни 1-й и 8-й (группа Б). Курсы повторяли каждые 3 недели. Ретроспективный анализ затрат был проведен с использованием критерия t Стьюдента для сравнения независимых групп.
Результаты.
В испытание было включено 509 больных (252 больных в группе А и 257 больных группе Б); все характеристики были хорошо сбалансированы. Медианное время выживаемости составляло 10,4 месяца (95%-ный доверительный интервал [ДИ] от 8,8 до 12 месяцев) для группы А и 9,8 месяцев (95%-ный ДИ от 8,0 до11,7 месяца) для группы Б (Р=0,32). Соответствующая выживаемость на срок в 1 год составляла 41,7 и 41,4%. Процент ответа для группы А составлял 28,0% (2% больных, давших полный ответ, ПО, 26% больных с частичным ответом, ЧО, 95%-ный ДИ от 22 до 34%). Процент ответа для группы Б составлял 35,0% (5% ПО, 30% ЧО, 95%-ный ДИ от 29 до 41%) (Р=0,12). Токсичность была незначительной. Нейтропения степени 3/4, тромбоцитопения и анемия отмечались у 15 и 15%, 2 и 1%, 5 и 2% для групп А и Б соответственно. Средние общие затраты (на визиты в амбулаторию и оплату препаратов для химиотерапии) составляли для группы А 7612,64 евро, а для группы Б 7484,77 евро. Различие не было статистически достоверным (Р<0,66).
Вывод.
Комбинация ПГ является столь же эффективной и хорошо переносимой, как и комбинация ПК у больных с немелкоклеточным раком легкого.
* * *
Рак легкого легкого одним из наиболее частых злокачественных заболеваний в мире и остается ведущей причиной онкологической смертности в западных странах [2, 3].
Частота этого заболевания нарастает, особенно среди женщин, среди которых рак легкого в настоящее время легкого ведущей причиной онкологической смертности в Соединенных Штатах [4]. Больные с распространенным заболеванием, получающие наилучшую форму поддерживающего ухода живут лишь несколько месяцев, приблизительно 90% умирает в пределах 1 года [1].
Химиотерапия дает только маргинальное преимущество в плане выживаемости при немелкоклеточном раке легкого (НМРЛ). Результаты нескольких мета-анализов показали, что комбинации, основанные на платине, удлиняют выживаемость у больных с распространенным НМРЛ по сравнению с наилучшим поддерживающим уходом [5, 6]. На протяжении последних нескольких лет в практику был введен ряд препаратов с новыми механизмами действия и значительной активностью в отношении НМРЛ, включая паклитаксел, доцетаксел, винорелбин, гемцитабин, иринотекан и тирапазамин [7].
Гемцитабин был подвергнут подробному изучению в форме монотерапии и дал приблизительно 20% ответ у больных, ранее не получавших химиотерапии по поводу распространенного НМРЛ [8-10]. По данным доклинических и клинических исследований, гемцитабин имеет синергизм с цисплатином, причем процент ответа для комьинации составляет от 52 до 54% в испытаниях по фазе II [11, 12].
Паклитаксел дает общий процент ответа в интервале от 20% до 42% у ранее не леченых больных с распространенным НМРЛ при годичной выживаемости, составляющей приблизительно 40% [13-16]. Комбинация паклитаксела и цисплатина дает хорошие ответы как у ранее не получавших химиотерапии больных, так и у ранее леченых больных с НМРЛ, причем дозоограничивающим фактором является нейротоксичность [17, 18].
Аналог цисплатина карбоплатин обеспечивает наилучшую годичную выживаемость с минимальной токсичностью, будучи применен в качестве монопрепарата в исследовании ECOG, проводившемся на пяти группах больных [19]. Карбоплатин обладает меньшей нефротоксичностью и дает меньшую частоту рвоты, чем цисплатин, кроме того, у него отсутствует нейротоксичность, При этом его общая эффективность близка к таковой цисплатина, а удобство для больного выше из-за легкости применения [20, 21].
При использовании комбинации паклитаксел/карбоплатин процент ответа варьирует от 27% до 62%, медиана времени выживания от 10 до 12 месяцев, а годичная выживаемость от 22 до 54% в отсутствие серьезных токсических эффектов [21-25].
Комбинация паклитаксела и гемцитабина особенно интересна среди неплатиновых схем, из-за различных механизмов действия этих препаратов, неперекрывающихся профилей токсичностей и активности. Возможно, что паклитаксел повышает противоопухолевую активность гемцитабина, и комбинация дает аддитивный эффект [26]. Несколько исследований по фазе I и II с использованием комбинации гемцитабин/паклитаксел у ранее нелеченых больных с НМРЛ показали, что процент ответа составляет от 24% до 47%, а токсичность имеет незначительный характер [27- 29].
На основании этих исследований Греческая кооперативная группа по онкологии (HeCOG) начала рандомизированное многоцентровое испытание по фазе III для сравнения обычно используемой комбинации паклитаксел/карбоплатин (ПК) с неплатиновой комбинацией паклитаксел/гемцитабин (ПГ). Главная задача заключалась в определении общей выживаемости и выживаемости за 1 год. Вторая задача заключалась в оценке ответа на лечение, времени до прогрессии и определении профиля токсичности для обеих комбинаций при лечении больных с распространенным неоперабельным НМРЛ.
БОЛЬНЫЕ И МЕТОДЫ
Критерии включения больных
В испытание включали больных, ранее не получавших химиотерапии; они должны были иметь возраст старше 18 лет и гистологически документированную неоперабельную рецидивирующую форму НМРЛ (неоперабельная стадия IIIa и IIIb, включая узлы средостения и/или выпот в плевру, или карциному стадии IV, в соответствии с критериями стадирования опухолей Американского совместного комитета по раку. Больные должны были иметь функциональный статус по ECOG (ФС) от 0 до 2. Другие требования включали наличие измеримого или пригодного для оценки заболевания в необлученных полях (если было документировано последующее заболевание), и ожидаемую продолжительность жизни не менее 12 недель. Больные со стабильными метастазами в мозг могли участвовать в испытании. Кроме того, больные должны были обладать достаточным резервом костного мозга и нормальными функциями почек и печени.
Больные с активной инфекцией и историей других новообразований (за исключением базальной карциномы кожи или карциномы шейки матки in situ) исключались из испытания. Также исключали больных, ранее получавших цитотоксическую химиотерапию, и больных с активным заболеванием сердца или уже имеющейся моторной или сенсорной нейропатией (степени 3 или 4 по ВОЗ). От женщин в детородном возрасте требовался результат анализа на беременность в пределах 48 часов перед записью в испытание. Перед лечением больные должны были подписать документ о согласие на участие, в соответствии с Хельсинкской декларацией и правилами медицинских учреждений, входящих в ECOG.
План лечения
Больные, удовлетворявшие критериям участия, направлялись в одну из двух групп. В группе А больных получали паклитаксел в дозе 200 мг/м2 в день 1 в форме 3-часового внутривенного вливания с последующим введением карбоплатина до AUC 6 (в соответствии с формулой Кальверта) в форме 1-часового внутривенного вливания. В группе Б больные получали паклитаксел в тех же дозах и форме введения, после чего вводился гемцитабин в дозе 1000 мг/м2 в форме 30-минутного внутривенного вливания в дни 1-й и 8-й каждого курса. Паклитаксел всегда вводили до карбоплатина или гемцитабина, используя следующую схему премедикации и профилактики рвоты: дексаметазон в дозе 20 мг перорально за 12 часов и внутривенно за 1 час до паклитаксела; димедрол в дозе 50 мг внутривенно за 30 минут до паклитаксела и циметидин (300 мг внутривенно) за 30 минут до паклитаксела. Кроме того, за 15 минут до химиотерапии вводили 16 мг ондансетрона внутривенно с последующим пероральным приемом в дозе по 8 мг на протяжении последующих 3 дней.
Лечение повторяли каждые три недели. Если у больного не было прогрессирующего заболевания, лечение продолжали в течение шести курсов. Если больной давал ответ, лечение продолжали по усмотрению врача. Больные со стадией IIIa и IIIb, давшие ответ на химиотерапию, получали после испытания местную лучевую терапию.
Модификации лечения
В случае развития гематологической и тяжелой негематологической токсичности в любой момент в ходе лечения, больных лечили при четырех уровнях доз (0, -1, -2, -3) следующим образом. Больных начинали вести на уровне доз 0, когда они получали паклитаксел в дозе 200 мг/м2 плюс карбоплатин до AUC 6 (группа А) или гемцитабин в дозе 1000 мг/м2 (группа Б). При наличии нейтропении и/или тромбоцитопении степени 3 по ВОЗ, нейротоксичности и гепатотоксичности степени 2 или диарреи степени 3 дозы обоих препаратов снижали до уровня –1 (группа А: паклитаксел 175 мг/м2 , карбоплатин до AUC 5; группа Б: паклитаксел 175 мг/м2 , гемцитабин 900 мг/м2). При развитии нейтропении или тромбоцитопении степени 4 или гепатотоксичности степени 3 препараты вводили на дозовом уровне –2 (группа А паклитаксел 150 мг/м2 , карбоплатин до AUC 4; группа Б: паклитаксел 150 мг/м2 , гемцитабин 800 мг/м2). При появлении нейтропенической лихорадки дозы снижали до уровня –3 (группа А: паклитаксел 140 мг/м2 , карбоплатин до AUC 4; группа Б: паклитаксел 140 мг/м2 , гемцитабин 700 мг/м2). После того как больных переводили на меньший дозовый уровень, у них не разрешалось увеличивать дозу в дальнейшем.
Для больных, не достигших восстановления картины крови на запланированный день лечения, полное содержание форменных элементов крови определяли два раза в неделю до достижения абсолютного содержания нейтрофилов, равного 2000/мкл и содержания тромбоцитов 1000000/мкл. Если гематологического восстановления по- прежнему не происходило к 35 дню, больную снимали с испытания. Больные также снимались с испытания, если у них появлялась симптоматическая аритмия или атриовентрикулярная блокада (за исключением блокады степени I), нейротоксичность степени 3 или гепатотоксичность степени 4, которые персистировали в течение 15 дней. Эти модификации, необходимые для безопасности наших больных, следовали из предыдущего опыта применения протоколов в нашей группе.
Исходные оценки и оценки в ходе лечения
Стадирование заболевания и ответ на лечение проводили путем клинического обследования, рентгена грудной клетки и компьютерно-томографического сканирования (получение КТ-скана). Исходная оценка включала получение полной истории болезни, физическое обследование, определение полного содержания форменных элементов крови и биохимического анализа крови. Опухоль, измеримая по двум осям, определяли с помощью методов визуализации (рентген грудной клетки, ультразвуковое исследование, КТ-сканирование, визуализация с помощью магнитного резонанса). КТ-сканирование в абдоминальной области, ультразвуковое исследование печени и надпочечников и сканирование костного скелета проводилось по усмотрению лечащего врача. Измерения опухоли для определения ответа на лечение выполнялись, по крайней мере, один раз в 6 недель; рентген грудной клетки повторяли раз в 3 недели.
Все гистопатологические стекла анализировались одной и той же группой патологов (связанной с больницами, участвовавшими в HeCOG).
Удовлетворявшие критериям участия больные, получившие, по крайней мере, два курса комбинированной химиотерапии, считались пригодными для оценки на ответ.
Удовлетворявшие критериям больные, получившие, по крайней мере, один курс химиотерапии, считались пригодными для оценки на токсичность. Для определения ответа использовались стандартные критерии ВОЗ. Время до прогрессии определялось как срок от начала химиотерапии до прогрессии заболевания, а выживаемость определялась как время от начала химиотерапии до летального исхода. Токсичность оценивали в соответствии с системой ВОЗ.
Статистический анализ
Рандомизация проводилась централизованно в офисе HeCOG. Больных включали в одну из двух групп с использованием центра в качестве фактора стратификации. При использовании уровня достоверности 0,05 и принимая во внимание стандартное отношение риска, равное 0,67, вероятность выявления достоверного различия между схемами составляет 95%, если регистрируется 404 летальных исхода. С учетом 10% выбывания больных из испытания, для выявления 50%-ного увеличения медианного контрольного значения выживаемости до 11 месяцев, в исследование необходимо было включить 440 больных. Темп набора больных в испытание, по имеющимся оценкам, составлял 150 больных в год, а максимальная продолжительность испытания должна была составлять 3 года.
Значения выживаемости и времени до прогрессии для групп лечения сравнивались с использованием лог-рангового теста. Метод Каплана-Мейрера использовался для оценки времени до события. Главные сравнения в отношении ответа были получены на основании когорты больных, пригодных для оценки на ответ, что проводилось с помощью критерия линейной ассоциации χ2 и точного критерия Фишера. Анализ регрессии с многими переменными и процедура обратной селекции использовалась для оценки наилучших прогностических факторов вероятности годичного выживания.
Данные по токсичности приводятся для всех больных, а сравнение между группами осуществлялось с помощью линейного критерия χ2. Все приведенные значения Р получены на основе двустороннего анализа с помощью программного пакета SPSS 8.0 (SPSS Inc., Чикаго, Иллинойс).
В конце испытания мы выполнили ретроспективный анализ затрат для каждой из групп. Двумя исследовавшимися факторами были абулаторные и клинические затраты и затраты на химиотерапевтические препараты. Для каждого фактора, влиявшего на анализ, были рассчитаны описательные статистические характеристики и проведены оценки с помощью критерия t Стьюдента для независимых выборок с целью сравнения фактора между группами.
РЕЗУЛЬТАТЫ
Характеристики больных
В период с февраля 1998 г. по сентябрь 2000 г. в испытание было включено всего 509 больных, 252 в группе А и 250 в группе Б – в 19 медицинских учреждениях. Все характеристики больных и характеристики заболевания до лечения (Таблицы 1 и 2, соответственно) были хорошо сбалансированы между обеими группами. Большинство больных составляли курящие мужчины с хорошим ФС и ограниченной потерей веса.
Большая часть опухолей представляли собой малодифференцированные плоскоклеточные опухоли или аденокарциномы.
Сроки до события Медианное время наблюдения для оценки времени событий для больных в группах А и Б составляло 20,7 месяца (интервал от 0,03 до 35,2+ месяца) и 20,5 месяцев (интервал от 0,07 до 30,4+ месяцев), соответственно. Медианное время наблюдения для обеих групп совместно составляло 20,7 месяцев (95%-ный ДИ от 18,0 до 21,5 месяцев). Всего шесть больных, по три в каждой группе, были потеряны для дальнейших обследований.
Таблица 1. Характеристики больных
Характеристика
Группа А
Группа Б
Число
больных%
Число
больных%
Включено
252
257
Удовлетворяет критериям
238
94,4
241
93,7
Возраст (годы)
Медиана 63
62
Интервал 31-81
30-84
Пол
Мужчины 208
87,0
211
88,0
Женщины 30
13,0
30
12,0
ФС по ECOG
0 127
53,0
124
52,0
1 79
33,0
88
36,0
2 32
14,0
29
12,0
Курение
Нет 23
10,0
23
10,0
Да 197
83,0
202
84,0
Неизвестно 18
7,0
16
6,0
Потеря веса более 10%
Нет 199
84,0
199
83,0
Да 34
14,0
40
16,0
Неизвестно 5
2,0
2
1,0
Предшествующая лучевая терапия
Нет 200
84,0
207
86,0
Основная локализация 24
10,0
21
9,0
Прочее 14
6,0
13
5,0
Предшествующая хирургия
Нет 201
84,0
202
84,0
Пневмэктомия 17
7,0
14
6,0
Лобэктомия 16
7,0
18
7,0
Прочее 4
2,0
7
3,0
Таблица 2. Характеристики заболевания
Характеристика
Группа А
Группа Б
Число
больных%
Число
больных%
Включено в испытание
252
257
Стадия по TNM
IIIa 19
8,0
24
10,0
IIIb 71
30,0
69
29,0
IV 148
62,0
148
61,0
Дифференцировка
Высокая
6
2,0
10
4,0
Промежуточная 49
21,0
44
18,0
Низкая 111
47,0
123
51,0
Малая 55
23,0
41
17,0
Неизвестно 17
7,0
23
10,0
Гистология
Плоскоклеточная 74
31,0
97
40,0
Аденокарцинома 112
47,0
82
34,0
Крупноклеточная 15
6,0
14
6,0
Недифференцированная 33
14,0
40
17,0
Смешанная 4
2,0
8
3,0
Число очагов метастазирования
1 14
6,0
13
5,0
2 97
41,0
98
41,0
3 75
31,0
73
30,0
>3 52
22,0
57
24,0
Лимфоузлы
Средостения 118
50,0
140
58,0
Надключичные 29
12,0
26
11,0
Шейные 18
8,0
21
9,0
Прочие 25
10,0
25
10,0
Печень
30
13,0
41
17,0
Мозг
13
5,0
12
5,0
Кости
54
23,0
55
23,0
Надпочечники
30
13,0
29
12,0
Прочее
53
22,0
49
20,0
Средняя общая выживаемость и время до прогрессии для групп А и Б достоверно не отличалось. Как показано на Рис. 1, медианное время выживания составляло 10,4 месяца (95%-ный ДИ от 8,8 до 12 месяцев) для группы А и 9,8 месяцев (95%-ный ДИ от 8,0 до 11,7 месяцев) для группы Б (Р=0,32). Среднее время до прогрессии составляло 6,3 месяца (95%-ный ДИ от 5,6 до 7,1 месяца) для группы А и 6,1 месяца (95%-ный ДИ от 5,4 до 6,8 месяцев) для группы Б (Р=0,76) (Рис. 2).
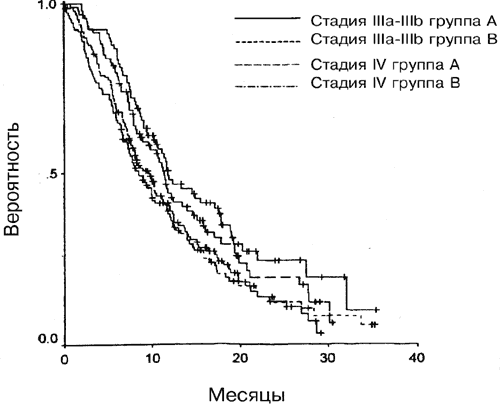
Для групп А и Б совместно медианная общая выживаемость для больных с ФС 0 или 1 была достоверно выше, чем для больных с ФС 2 (11,1 и 5,9 месяецв, соответственно) (Р=0,0001); это же относится и к медианному значению времени до прогрессии (6,6 и 3,8 месяцев, соответственно; Р<0,0001). Достоверные различия в отношении эффективности были также обнаружены в каждой группе в связи с ФС, как показано на Рис. 3 (Р<0,001 в обоих случаях). Медианная выживаемость больных со стадией заболевания III была достоверно выше, чем для больных со стадией IV (11,5 и 8,9 месяцев, Р=0,002), как и медианное значение времени до прогрессии (6,7 и 5,7 месяцев, Р=0,002). Только в группе А стадии по системе TNM (опухоль, лимфоузел, метастаз) IIIa, IIIb и IV достоверно коррелировали с выживаемостью (Р=0.01). Значение Р для группы Б составляло 0,05 (Рис. 4).
Значения выживаемости за один и два года составляли 41,7% и 17% для группы А и 41,4 и 15,2% для группы Б. Для групп А и Б совместно не наблюдалось достоверных различий между больными со стадией III и IV заболевания в плане годичной выживаемости (46,0% и 38,8%, соответственно, Р=0,010). Однако вероятность выживания в течение года была достоверно более высокой для больных с ФС 0 или 1 чем для больных с ФС 2 (44,4% и 20,9%, Р=0,0005).
Анализ с использованием многих переменных показал, что ФС (P<0,0001), поражение костей (P=0,001), надключичного лимфатического узла (P<0,0001) и печени (P<0,0001) являются достоверными прогностическими факторами для годичной выживаемости.
Гистологический тип (аденокарцинома или плоскоклеточная карцинома) не влияли на общую выживаемость (Р=0,22). Лечение не влияло на выживаемость (Р=0,33). Тот же анализ в отношении времени до прогрессии вновь показал, что ФС (Р<0,0001) и поражение костей (Р=0,07), надключичного лимфатического узла (Р=0,001) и число локализаций метастазирования (Р=0,01) являются достоверными прогностическими факторами.
Ответ
Сорок девять больных (25 в группе А и 24 в группе Б) было сочтено не удовлетворяющими критериям для оценки ответа: 19 (10 в группе А и 9 в группе Б) из- за ухода из испытания по собственному желанию, 4 (3 в группе А и 1 в группе Б) из-за токсических аллергических реакций в ходе первого курса химиотерапии, заставивших их выбыть из испытания, 5 (3 в группе А и 2 в группе Б) из-за ранней прогрессии заболевания и 21 (11 в группе А и 10 в группе Б) из-за невыполнения критериев вхождения в испытание. Таким образом, всего для оценки ответа мы имели 238 больных в группе А и 241 больного в группе Б.
Среди больных в группе А отмечалось 5 случаев полного ответа (ПО) и 62 случая частичного ответа (ЧО), для больных в группе Б отмечалось 11 случаев ПО и 73 случая ЧО. Таким образом, общий процент ответа составлял 28% (2% ПО, 26% ЧО; 95%-ный от 22 до 34%) в группе А и 35% (5% ПО и 30% ЧО, 95%-ный ДИ от 29 до 41%) в группе Б. Значения общего ответа между группами достоверно не различались (Р=0,12).
Общий процент ответа для всех больных со стадиями III и IV составлял 36% (95%-ный ДИ от 31 до 49%) и 29% (95%-ный ДИ от 22 до 35%) (Р=0,10). Больные с ФС 2 давали малый процент ответа, составлявший 11% (95%-ный ДИ от 0 до 20%), в то время как для больных с ФС 0 или 1 общий ответ наблюдался у 34% (95%-ный ДИ от 30 до 41%) (Р<0,0001).
Токсичность
Лечение обычно хорошо переносилось в обеих группах, и госпитализаций не потребовалось. В целом, профили гематологической токсичности для групп А и Б были одинаковыми (Таблица 3). Летальных исходов за счет токсичности не было.
Таблица 3. Токсические эффекты степени 3/4 по ВОЗ (% больных)
Группа А (n=234)
Группа Б (n=239)
Степень 3 (%)
Степень 4 (%)
Степень 3 (%)
Степень 4 (%)
Гематологические
Анемия
4
1
2
0
Лейкопения
5
2
9
1
Тромбоцитопения
1
1
1
0
Нейтропения
5
10
10
5
Негематологические
Лихорадка (не за счет нейтропении)
0,5
0
1
0
Лихорадка из-за инфекции
1
0
2
0
Тошнота/рвота
4,3
0
6,5
0
Алопеция
51
3
48
5
Нейротоксичность
8
0
6
0
Нефротоксичность
0
0
0,5
0
Кардиотоксичность
0,5
0
0
0
Диарея
0,5
0,5
0,5
0
Артралгия/миалгия
0,5
0
0,5
0
Чувство усталости
1
0
1
0
Аллергическая реакция
0,5
0,5
1
1
Гематологическая токсичность носила легкий характер. Нейтропения степени 3/4 наблюдалась у 15% больных в обеих группах; она была транзиторной и имела небольшую продолжительность, а о случаях нейтропенического сепсиса не сообщалось. Тромбоцитопения степени 3/4 наблюдалась у 2% (степень 3/4) больных в группе А и у 1% (степень 3) у больных в группе Б, однако ни у одного из больных не возникло кровотечения и не потребовалось переливания тромбоцитов. Анемия степени 3/4 наблюдалась у 5% (степень 3/4) больных в группе А и у 2% (степень 3) больных в группе Б. Двадцать больных получили переливания эритроцитарной массы на амбулаторной основе.
Негематологическая токсичность также носила легкий характер в обеих группах (Таблица 3). Лихорадка, которая обычно имела низкую степень выраженности, была связана главным образом с введением гемцитабина и продолжалась в течение нескольких часов. Лихорадка, вызванная инфекцией, связанной с нейтропенией, отмечалась у 3% больных совместно в обеих группах (1% в группе А и 2% в группе Б).
Частота тошноты и рвоты была низкой в обеих группах, причем степень 3 была характерна для 4,5% больных в группе А и наблюдалась у 6,5% больных в группе Б.
Нейротоксичность степени 3 наблюдалась у 8% больных в группе А и у 6,5% больных в группе Б и отмечалась чаще после третьего курса химиотерапии. Алопеция носила универсальный характер, причем алопеция степени 3/4 составляла у 54% и 53% в группах А и Б, соответственно. Отмечавшиеся редко (1% всех больных) артралгии/миалгии, которые также были связаны с лечением паклитакселом, наблюдались между вторым и четвертым днями после вливания; однако они обычно носили легкий характер и больные частично реагировали на прием нестероидных противовоспалительных препаратов. Аллергические реакции степени 3/4 в связи с лечением паклитакселом проявлялись во время второго курса химиотерапии у 1% и 2% больных в группах А и Б, соответственно. Хотя больные реагировали на антиаллергическую терапию, состоявшую из стероидов и адреналина, эти события потребовали прекращения лечения. Гематологическая и негематологическая токсичность у больных с ФС 0-1 не отличалась от того, что наблюдалось у больных с ФС 2.
Доставленные дозы Больным групп А и Б было проведено всего 1154 и 1089 курсов химиотерапии, соответственно. Медианное число завершенных курсов было равно шести (интервал от одного до девяти курсов) в группе А и пяти (интервал от одного до девяти курсов) в группе Б. Очень небольшое число больных получило более шести курсов (20 больных в группе А и 12 больных в группе Б) из-за продолжающегося уменьшения размеров опухоли. Медиана продолжительности лечения для групп А и Б, соответственно, составляла 18 недель (интервал от 3 до 31 недели) и 18 недель (интервал от 3 до 26 недель).
Относительная интенсивность дозы паклитаксела составляла 0,94 для группы А и 0,89 для группы Б. Относительная интенсивность дозы гемцитабина составляла 0,89, а медианная кумулятивная доза карбоплатина составляла 2852 мг. Процент курсов, которые были отложены, составлял 12% для группы А и 17% для группы Б. Эти задержки были вызваны лейкопенией.
Затраты
Всего 472 больных (232 в группе А и 240 в группе Б) были ретроспективно проанализированы в отношении затрат на проведение испытания. Что касается визитов в амбулаторию, больным в группе А потребовалось достоверно меньше дней (в среднем 4,9 дня) по сравнению с группой Б (в среднем 8,8 дней) (Р(<0,005).
Соответственно, затраты на амбулаторную клинику были значительно выше для группы Б (в среднем 515,0 евро по сравнению с 289,7 евро в группе А; Р<0,05).
Больные в группе А получили больше паклитаксела (в среднем 1659 мг) по сравнению с группой Б (в среднем 1520 мг) (Р<0,05), однако гемцитабин для больных в группе Б был более дорогостоящим (в среднем 1423,5 евро) по сравнению с карбоплатином в группе А (в среднем 1275,4 евро) (Р=0,01). Таким образом, различия между двумя группами в отношении общих затрат на химиотерапевтические препараты было недостоверным. В частности, когда все затраты (общая стоимость препаратов и визитов в амбулаторию) были объединены, достоверного различия между группами не наблюдалось (Р=0,66) (Таблица 4).
Таблица 4. Затраты средств и времени в ходе лечения
*Критерий t Стьюдента для группы А по сравнению с группой Б.
Группа А
Группа Б
Р*
Среднее ± СО
Среднее ± СО
Визиты в поликлинику (дни)
4,93±1,85
8,77±4.03
<0,05
Визиты в поликлинику (оплата)
289,68±109,09
515,04±236,55
<0,05
Стоимость химиопрепаратов
7322,96±2905,34
6969,73±3142,33
0,21
Расходы всего
7612,64±3014,43
7484,77±3378,88
0,66
ОБСУЖДЕНИЕ
Мы нашли, что в настоящем рандомизированном испытании по фазе III комбинации ПГ и ПК обладали аналогичной эффективностью и хорошей переносимостью. Общая выживаемость была близкой для обеих групп: 9,8 месяца для группы ПГ (группа Б) и 10,4 месяца для ПК (группа А), соответственно. Медиана выживаемости для больных с ФС равным 2 была достоверно ниже, чем для больных с ФС от 0 до 1 (5,9 и 11,1 месяца; Р<0,0001). Это также относилось к больным со стадией заболевания IV по сравнению с больными со стадией III (8,9 и 11,5 месяца, соответственно; Р=0,002).
Однако при анализе групп по стадиям системы TNM (IIIa/IIIb или IV) только в группе А было обнаружено достоверная зависимость выживания от стадии (Р=0,01).
Гистологический тип не влиял на общую выживаемость (Р=0,22). Годичная выживаемость больных в обеих группах была одинаковой (41,7% для ПК и 41,4% для ПГ). Соответствующее значение выживаемости за 2 года составляло 17% и 15,2%. Как и в случае выживания, время до прогрессии было одинаковым в обеих группах, но больные с ФС 2 давали худшие результаты по сравнению с больными, имевшими ФС 0- 1 (3,8 месяца и 6,6 месяца, соответственно).
Общий процент ответа для схем ПК и ПГ составлял 35 и 28%, соответственно. Хотя активность на схеме ПГ была более высокой, различие между группами не было достоверным. Ответ наблюдался в отношении всех метастатических локализаций заболевания. Проценты ответа не отличались достоверно между больными со стадией III по сравнению со стадией IV, однако этот процент был достоверно более высоким для больных с ФС 0-1 по сравнению с больными, имевшими ФС 2 (Р<0,0001). В последней группе только 11% больных дали ответ на лечение, а это указывает, что данная подгруппа больных с НМРЛ с пониженным функциональным статусом требует иного подхода к лечению. В испытании ECOG 1594 процент ответа, время до прогрессии, медианная выживаемость и выживаемость за 1 год для больных с ФС 2, получавших схему ПК, составляли 13%, 1,5 месяца, 4,6 месяца и 13,3%, соответственно [30].
В целом, токсичность имела легкий характер и хорошо переносилась больными в обеих группах (Таблица 3). Фактически она не требовала госпитализации. Нейтропения степени 3/4 была транзиторной, непродолжительной и не приводила к сепсису; тромбоцитопения была крайне незначительной. Летальных исходов в связи с токсичностью описано не было. Токсичность у больных с ФС 2 не отличалась по сравнению с тем, что наблюдалось у больных, имевших ФС от 0 до 1, как и было сообщено в испытании ECOG 1594 [30].
Различные платиносодержащие комбинации обладают сходной активностью [31, 32].
Представляется, что неплатиновые комбинации также обладают сходной активностью [33, 34].
Одним из важных соображений, касающихся выбора надлежащей схемы лечения, является стоимость. В настоящем испытании мы попытались проанализировать расходы для каждой группы ретроспективно, хотя мы понимаем, что этот подход не является научно строгим методом анализа затрат. Однако, принимая во внимание сходство эффективности и токсичности в двух группах и то, что фактически не требовалось госпитализации или каких-либо мер поддержки, было логично связать затраты главным образом с визитами больных в амбулаторию и расходами на препараты для химиотерапии. Клинические затраты для поликлинических больных были достоверно более высокими для больных, получавших ПГ (Р<0,05), в то время как затраты на препараты для химиотерапии в группах лечения достоверно не отличались (Р=0,21). Это можно объяснить тем, что больные в группе ПК получали больше курсов химиотерапии и более высокую интенсивность дозы паклитаксела по сравнению с больными в группе ПГ. Общие затраты, состоявшие из стоимости препаратов для химиотерапии и клинических амбулаторных затрат, достоверно не отличались для двух групп (Р=0,66) (Таблица 4).
Итак, неплатиновая комбинация ПГ продемонстрировала профиль активности и токсичности, сходный с профилем обычно применяемой комбинации ПК.
Выживаемость больных с ФС 2 была ниже при использовании обеих комбинаций. Хотя комбинация ПГ требовала большего количества визитов больных в клинику, затраты на лекарственный препарат и затраты в целом были такими же, как при использовании комбинации ПК.
Литература
1. Ginsberg RJ, Vokes ЕЕ, Rosenzweig К: Non small cell lung cancer, in De Vita Jr, Hellman S, Rosenberg SR (eds): Cancer: Principles and Practice of Oncology (ed 6). Philadelphia, PA, Lippin-cott-Raven, 2001, pp 925-983
2. Landis SM, Murray T, Bolden S, et al: Cancer statistics, 1998. CA Cancer J Clin 48:6-29, 1998
3. Lubin JM: Lung and larynx, in Cancer Rates and Risks (ed 4). Bethesda, MD, National Institutes of Health, National Cancer Institute, 1996, pp 158-161
4. Greenlee RT, Hill-Harmon MB, Murray T, et al: Cancer statistics, 2001. CA Cancer J Clin 51:15-36, 2001
5. Chemotherapy in non-small cell lung cancer: A meta-analysis using updated data on individual patients from 52 randomized clinical trials—Non-small Cell Lung Cancer Collaborative Group. BMJ 311:899-909, 1995
6. Cullen MH, Billingham „\, Woodroffe CM, et al: Mitomycin, ifosfamide and cisplatin in unresectable non-small-cell lung cancer: Effects on survival and quality of life. J Clin Oncol 17:3188-3194, 1999
7. Lilenbaum RC, Green MR: Novel chemotherapeutic agents in the treatment of non-smallcell lung cancer. J Clin Oncol 11:1391-1402, 1993 8. Barton-Burke M: Gemcitabine: A pharmacologic and clinical overview. Cancer Nurs 22:176-183, 1999 (review)
9. Shepherd FA: Phase II trials of single-agent activity of gemcitabine in patients with advanced non-small cell lung cancer: An overview. Anticancer Drugs 6:19-25, 1995
10. Gatzemeier U, Shepherd FA, Le Chevalier T, et al: Activity of gemcitabine in patients with non-small cell lung cancer: A multicentre, extended phase II study. Eur J Cancer 32A:243-248, 1996
11. Crino L, Scagliotti G, Marangolo M, et al: Cisplatin-gemcitab-ine combination in advanced non-small-cell lung cancer: A phase II study. J Clin Oncol 15:297-303. 1997
12. Abratt RP, Bezwoda WR, Goedhals L, et al: Weekly gemcitabine and monthly cisplatin: Effective chemotherapy for advanced non-small-cell lung cancer. J Clin Oncol 15:744-749, 1997
13. Rowinsky EK, Donehower RC: Taxol: Twenty years later, the story unfolds. J Nati Cancer Inst 83:1778-1781, 1991
14. Murphy WK, Fossella FV, Winn RJ, et al: A phase II study of taxol in patients with untreated advanced non-small-cell lung cancer. J Nati Cancer Inst 85:384-388. 1993
15. Gatzemeier U, Heckmayer M, Neuhauss R, et al: Chemotherapy of advanced inoperable non-small cell lung cancer with paclitaxel: A phase II trial. Semin Oncol 22:24-28, 1995 (6 suppl 15)
16. Hainsworth JD, Thompson DS, Greco FA: Paclitaxel by 1-hour infusion: An active drug in metastatic non-small-cell lung cancer. J Clin Oncol 13:1609-1614, 1995
17. Rowinsky EK, Gilbert MR, McGuire WP, et al: Sequences of taxol and cisplatin: A phase I and pharmacologic study. J Clin Oncol 9:1692-1703, 1991
18. Rowinsky EK, Chandbry V, Forastiere AA, et al: Phase I and pharmacologic study of paclitaxel and cisplatin with granulocyte colony-stimulating factor: Neuromuscular toxicity is dose-limiting. J Clin Oncol 11:2010-2020, 1993
19. Bonomi PD, Finkelstein DM, Ruckdeschel JC, et al: Combination chemotherapy versus single agents followed by combination chemotherapy in stage IV non-small-cell lung cancer: A study of the Eastern Cooperative Oncology Group. J Clin Oncol 7:1602-1613, 1989
20. Calvert АН, Newell DR, Gumbrell LA, et al: Carboplatin dosage: Prospective evaluation of a simple formula based on renal function. J Clin Oncol 7:1748-1756, 1989
21. Kosmidis PA, Mylonakis N, Fountzilas G, et al: Paclitaxel and carboplatin in inoperable non-small-cell lung cancer: A phase II study. Ann Oncol 8:697-699, 1997
22. Langer CJ, Leighton JC, Comis RL, et al: Paclitaxel and carboplatin in combination in the treatment of advanced non-small-cell lung cancer: A phase II toxicity, response, and survival analysis. J Clin Oncol 13:1860-1870, 1995
23. Johnson DH, Paul DM, Hande KR, et al: Paclitaxel plus carboplatin in advanced nonsmall- cell lung cancer: A phase II trial. J Clin Oncol 14:2054-2060, 1996
24. Kelly К, Pan Z, Murphy J, et al: A phase I trial of paclitaxel plus carboplatin in untreated patients with advanced non-small cell lung cancer. Clin Cancer Res 3:1117-1123, 1997
25. Kosmidis P, Mylonakis N, Skarlos D, et al: Paclitaxel (175 mg/m2) plus carboplatin (6 AUC) versus paclitaxel (225 mg/m2) plus carboplatin (6 AUC) in advanced non-small-cell lung cancer (NSCLC): A multicenter randomized trial—Hellenic Cooperative Oncology Group (HeCOG). Ann Oncol 11:799-805, 2000
26. Kroep JR, Giaccone G, Voon DA, et al: Gemcitabine and paclitaxel: Pharmacokinetic and pharmacodynamic interactions in patients with non-small-cell lung cancer. J Clin Oncol 17:2190-2197, 1999
27. Giaccone G, Smith EF, van Meerbeeck JP, et al: A phase I-II study of gemcitabine and paclitaxel in advanced non-small-cell lung cancer patients. Ann Oncol 11:109-112, 2000
28. Monnier A, Douillard JY, Lerouge D, et al: Results of a phase II study with Taxol (paclitaxel) and Gemzar (gemcitabine) in metastatic non-small cell lung cancer (NSCLC).Proc Am Soc Clin Oncol 19:516a, 2000 (abstr 2021)
29. Auerbach M, Chaudhry M, Richards P, et al: Phase II study of gemcitabine and paclitaxel in metastatic non-small cell lung cancer. Proc Am Soc Clin Oncol 19:522a, 2000 (abstr 2052)
30. Sweeney CJ, Zhu J, Sandier AB, et al : Outcome of patients with a performance status of 2 in Eastern Cooperative Oncology Group Study E 1594: A phase III trial in patients with metastatic non-small cell lung carcinoma. Cancer 92:2639-2647, 2001
31. Scagliotti GV, De Marinis F, Rinaldi M, et al: Phase III randomized trial comparing three platinum-based doublets in advanced non-small cell lung cancer. Proc Am Soc Clin Oncol 20:308a, 2001 (abstr 1227)
32. Schiller JH, Harrington D, Belani C, et al: Comparison of four chemotherapy regimens for advanced non-small cell lung cancer. N Engi J Med 346:92-98, 2002
33. van Meerbeeck JP, Smit EF, Lianes P, et al: An EORTC randomized phase III trial of three chemotherapy regimens in advanced non-small cell lung cancer (NSCLC). Proc Am Soc Clin Oncol 20:308a, 2001 (abstr 1228)
34. Georgoulias V, Papadakis E, Alexopoulos A, et al: Platinum-based and non-platinumbased chemotherapy in advanced non-small-cell lung cancer: A randomised multicentre trial.Lancet 357:1478-1484, 2001Рис. 1. Медианы выживаемости для групп А и Б (Р=0,32). Сплошная линия – группа А, штриховая линия – группа Б.
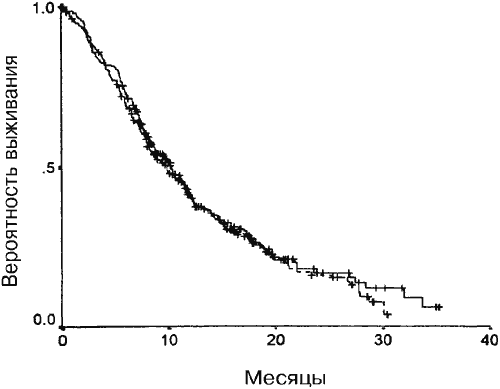
Рис. 2. Медианы времени до прогрессии для групп А и Б (Р=0,36). Сплошная линия – группа А, штриховая линия – группа Б.
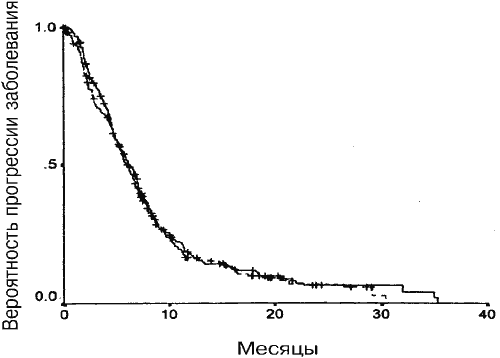
Рис. 3. Влияние ФС на выживаемость для каждой из групп.
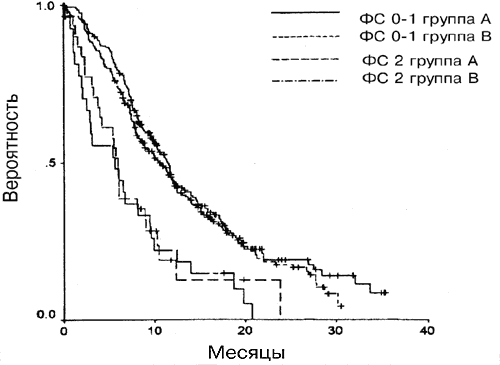
Рис. 4. Влияние стадии по TNM на выживаемость в группах А (Р=0,01) и группе Б (Р=0,05).
| Январь 2004 г. |